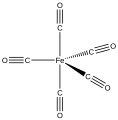
Anorganická chemie/Triáda železa
Prvky triády železa se vyznačují vysokými teplotami tání a varu, k nimž mají poměrně malý molární objem. Jsou kujné a tažné. Důležitou vlastností společnou pro všechny tři prvky je paramagnetismus.
Železo, kobalt a nikl se svými vlastnostmi a reaktivitou podobají chromu a manganu, podobnost je zřetelná nejvíce ve dvojici železo, mangan. Triáda železa se podílí na vzniku mnoha slitin a různých intermetalických sloučenin. Vytváří koordinační sloučeniny v různých oxidačních stavech, výjimkou je nikl, který komplexech víceméně neposkytuje. Valná většina koordinačních sloučenin se bez ohledu na oxidační stupeň užívá jako oxidační činidla. Kobalt a nikl na rozdíl od železa disponují odolností vůči korozi, nikl dokonce nachází užití jako antikorozní ochrana kovových povrchů. [1][2]

| Železo (Fe) | Kobalt (Co) | Nikl (Ni) | |
|---|---|---|---|
| Atomové číslo | 26 | 27 | 28 |
| Teplota táni (°C) | 1538 | 1495 | 1455 |
| Teplota varu (°C) | 2862 | 2870 | 2913 |
| Hustota (g/cm3) | 7,874 | 8,900 | 8,908 |
| Elektronová konfigurace | 3d6 4s2 | 3d7 4s2 | 3d8 4s2 |
| Curieova teplota (°C) | 768 | 1120 | 363 |
| Objev | pravěk | 1735 | 1751 |
Železo
[editovat | editovat zdroj]Železo je druhým nejrozšířenějším kovem na Zemi a zároveň čtvrtým nejrozšířenějším prvkem v zemské kůře. V této kategorii ho předčí kyslík, křemík a hliník. Železo je také díky stabilitě jader značně rozšířeno i ve vesmíru, kde hraje klíčovou roli ve vývoji hvězd. Lidé pracují se železem od nepaměti, nejstarší objev železných kuliček se datuje z doby 6 000 let př.n.l., jednalo se o tzv. meteoritické železo. Získání železa tavením rud a následné zpracování kováním začal využívat národ Chetitů z Malé Asie o dlouhých 3 000 let později. Chetité udržovali recept na přípravu železa po dlouhá staletí v tajnosti, až do rozpadu jejich říše 1 200 let př.n.l., následující období je známo jako doba železná. Železo má obrovský význam pro výrobu slitin, převážně ocelí. V neposlední řadě je možné na železo narazit i v těle člověka, jedná se tedy o biogenní prvek. V lidském těle hraje důležitou roli jakožto přenašeč v buněčném dýchání, zároveň je součástí komplexu, který dává krvi její červené zbarvení.[1][2][3][4][5]
Fyzikální a chemické vlastnosti železa
[editovat | editovat zdroj]Železo je relativně měkký, neušlechtilý a kujný kov světle šedé barvy. Taje při teplotě 1 538 °C, do plynného skupenství přechází po dosažení teploty 2 862 °C. Elektronová konfigurace valenční sféry železa je 3d6 4s2. Železo má čtyři stabilní izotopy, nejvíce zastoupeným izotopem je 56Fe (91,75 %). V jednotkách procent se dá potom narazit na 54Fe (necelých 6 %), 57Fe (2,12 %) a v nejmenším zastoupení, lehce přes 2 %, 58Fe. Jedná se o feromagnetický kov, který není příliš odolný proti korozi. Na vlhkém vzduchu se pomalu oxiduje, vzniká hydratovaný oxid železitý, tedy rez. Korozi železa je možné předejít například výrobou slitin s jinými kovy.[3][4]
Železo je jedním z přechodných prvků, které se vyznačují tím, že nemají zcela zaplněné d-orbitaly. Nejčastějšími oxidačními stavy jsou +II a +III. Většina sloučenin železa je silně feromagnetických, příčinou je elektronová konfigurace d5 a d6 v oxidačních stavech +II a +III. Dále se můžeme potkat s železem v oxidačním stavu +IV, tyto sloučeniny jsou však velmi nestabilní. Železany (+VI) jsou stabilními sloučeninami, v chemii se využívají jejich silné oxidační schopnosti. Železo je mimo jiné součástí mnoha komplexů, v některých z nich se nachází dokonce i v nestandardním oxidačním stavu -II.
Elementární železo je z chemického hlediska nestálé a reaktivní. V práškové formě je na vzduchu samozápalné (pyroforické). Jelikož je železo neušlechtilé, snadno se rozpouští v kyselinách a poskytuje tak železnaté soli a vodík. Rozpouští se konkrétně v koncentrované kyselině chlorovodíkové, ve zředěné kyselině sírové a ve zředěné kyselině dusičné. Při reakci s koncentrovanou kyselinou dusičnou, stejně tak s koncentrovanou kyselinou sírovou, se nerozpouští, pouze se pasivuje na povrchu. S hydroxidy se slučuje až po zahřátí. Za zvýšené teploty reaguje taktéž s halogeny, uhlíkem, sírou, fosforem a s křemíkem. Celkově se vyznačuje silnou afinitou ke kyslíku. Na vlhkém vzduchu koroduje, avšak k reakci se suchým vzduchem dochází až při dosažení teploty 150°C. Leč se samotnou vodou bez přístupu vzduchu železo nereaguje vůbec.[5][6][7][8]
Alotropické modifikace
[editovat | editovat zdroj]
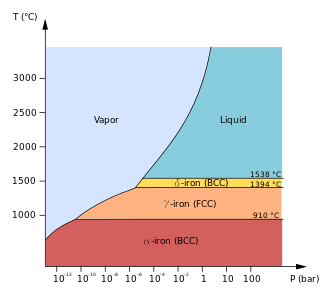
Čisté železo krystaluje v různých krystalických mřížkách. Vyskytuje se ve třech alotropických modifikacích, α-železo, γ-železo a δ-železo. První modifikace, α- železo (ferit), krystaluje v kubické prostorově centrované mřížce (BCC) a je stálé do 906 °C. Železo je feromagnetické pouze do teploty 768 °C (Curieův bod), v teplotním intervalu 768 – 906 °C se v minulosti označovalo jako β-železo, přestože se od α-železa strukturálně nijak neliší. Jediným rozdílem je přechod z feromagnetismu na paramagnetismus feritu při přesažení Curieova bodu.
Další alotropní modifikací je γ-železo (austenit), které krystaluje v kubické plošně centrované mřížce (FCC) a je stabilní do 1 401 °C. Tato forma je paramagnetické v celém teplotním rozsahu, v němž se vyskytuje. Třetí a poslední modifikací je δ-železo, které je stálé při teplotách přesahujících 1 401 °C. Jeho krystalová mřížka je opět kubická plošně centrovaná (BCC), stejně jako byla u feritu. Na rozdíl od feritu má mřížka větší mřížkový parametr. Horní hranicí stability δ-železa je teplota tání železa, 1 538°C. [9][10]
Různé krystalické mřížky ovlivňují mimo jiné i rozpustnost uhlíku. Koordinační číslo BCC mřížky je 8, zatímco koordinační číslo FCC mřížky je 12. Modifikace γ- železa s kubickou plošně centrovanou mřížkou disponuje značně vyšší rozpustností uhlíku než modifikace α. Vysvětlení spočívá v tom, že ačkoliv má γ verze vyšší koordinační číslo, uspořádání intersticiálního prostoru je praktičtější. Tento fakt poukazuje i na skutečnost, že s teplotou roste i objem železa, což znamená, že objem železa roste při přechodu mezi krystalickými modifikacemi α a γ. [11][3][12][13]
Výskyt v přírodě
[editovat | editovat zdroj]Průměrný obsah železa v zemské kůře se pohybuje v rozmezí 4,7 – 6,2 %. Díky stálosti jader není železo vysoce rozšířeno pouze na Zemi, ale i ve vesmíru. Například na Měsíci dosahuje zastoupení železa v kůře až 9 % (56 300 ppm), zároveň je jeho přítomnost dokázána v měsíčním prachu, ve hvězdách a v meteoritech. V přírodě se železo vyskytuje pouze ve sloučeninách, nejčastěji ve formě oxidů, případně jako uhličitany, hydroxidy nebo sulfidy. Za jedinou ryzí formu železa je možné považovat meteoritické železo. Tvrdost železných rud se většinou pohybuje mezi 4,5 – 6,5 dle Mohsovy stupnice tvrdosti.
Nejrozšířenější rudou železa je hematit (krevel), chemicky oxid železitý (Fe2O3). Obsah železa v hematitu dosahuje 70 %, jedná se o nejvýznamnější železnou rudu. Hematit je křehký a slabě magnetický. Soustava je klencová, barva šedá až černá, doplněná kovovým leskem. Skládá se z oválných útvarů, které tvoří paprsčitě vláknité agregáty. Jeho krystaly často dvojčatně srůstají. Hematit je rozpustný v koncentrované kyselině chlorovodíkové. V Česku se těží na Příbramsku poblíž obce Narysov, ve světě nalezneme ložiska hematitu v Kanadě, v Afghánistánu, na Ukrajině, v Nigérii a na mnoha dalších místech.
Nejušlechtilejší rudou železa je magnetit (magnetovec), jehož chemický vzorec je Fe3O4 (oxid železnato-železitý). Nejušlechtilejší, protože disponuje nejvyšším obsahem železa, který v nejčistějších formách dosahuje až 72 %, zbylých 28 % pak tvoří kyslík a příměsi. Příměsi, v podobě hliníku, chromu, vanadu, titanu a jiných, se vyskytují v nepatrném množství, v některých formách magnetitu mohou představovat i 7 % složení. Jeho soustava je krychlová, barva černá, taktéž obohacená kovovým leskem. Magnetit byl prvním nerostem, u něhož byly objeveny magnetické vlastnosti. Také se nachází v některých živých organismech (např. včely, holubi), pravděpodobně jim umožňuje orientovat se podle magnetického pole Země. V Česku magnetit nalezneme v Krušných horách a na Českomoravské vrchovině. Světově proslulá ložiska magnetitu jsou v Rusku na Uralu anebo v severním Švédsku u města Kiruna. Mimo jiné je součástí meteoritů.[14]
Další, také velmi významnou rudou železa je limonit (hnědel) aneb hydrát oxidu železitého (Fe2O3·x H2O). Limonit je jemnozrnnou směsí několika minerálů, převážně goethitu a lepidokrokitu. Limonit nemá krystaly, soustava je tedy amorfní, barva okrová až hnědočervená. Na povrchu občas vznikají kovově lesklé povlaky, tzv. náběhové barvy. Mezi naleziště limonitu řadíme Krušné Hory, Příbram a ve světovém měřítku například Krym nebo ve Švédsku na dně jezer.
V neposlední řadě musí být zmíněn pyrit, jehož vzorcem je FeS2 (disulfid železnatý). Pyrit bývá pro svou zlatavou barvu nazýván kočičím zlatem. Pro komplikované oddělení železa od síry se pyrit k průmyslové výrobě železa neužívá. Jelikož není pyrit na zemském povrchu stabilní, těží se v hlubinných dolech. Na našem území se vyskytuje v Kutné Hoře, v Jáchymově, v okolí Kladna a v mnoha dalších oblastech. Ve světovém měřítku je možné na pyrit narazit v pohoří Ural, ve Španělsku (ložisko Rio Tinto), v Itálii a v dalších zemích. Mezi další, méně významné rudy železa patří siderit, olivín, chromit, wolframit, ilmenit, augit a jiné.
Siderit neboli meteoritické železo tvoří slitina železa a niklu. Pravděpodobně se jedná o zbytky rozpadu jader drobných planetek. Pozor, pod pojmem siderit je známá i hornina FeCO3 (uhličitan železnatý). Jedinou společnou vlastností meteorického železa a minerálu siderit, je obsah železa. Uhličitan železnatý tvoří zrnité, případně celistvé agregáty, struktura je klencová (trigonální). [2][11][12][14]
-
Hematit (krevel)
-
Magnetit (magnetovec)
-
Magnetit
-
Limonit (hnědel)
-
Pyrit (kočičí zlato)
-
Pyrit
-
Goethit
-
Siderit (ocelek)
-
Siderit
-
Ilmenit
| Název sloučeniny | Historický názek | Vzorec | Obsah Fe (hm.%) |
|---|---|---|---|
| Hematit | Krevel | Fe2O3 | 70 |
| Magnetit | Magnetovec | Fe3O4 | 72 |
| Goethit | - | FeO(OH) | 63 |
| Pyrhotin | - | FeS | 63 |
| Limonit | Hnědel | Fe2O3 · X H2O | 52 - 62 |
| Siderit | Ocelek | FeCO3 | 48 |
| Pyrit | - | FeS2 | 46 |
| Ilmenit | - | FeTiO3 | 37 |
Výroba železa a ocelí
[editovat | editovat zdroj]Výroba čistého železa
[editovat | editovat zdroj]Pro výrobu čistého železa existují dvě základní metody. Buď se čisté železo vyrábí redukcí oxidu, případně hydroxidu vodíkem anebo tzv. karbonylovým způsobem. Karbonylová příprava železa spočívá v zahřátí železa v atmosféře oxidu uhelnatého za zvýšeného tlaku. Reakcí vzniká pentakarbonyl železa, Fe(CO)5, oranžová kapalina. Pentakarbonyl železa je přečištěn destilací, mezi běžné nečistoty patří uhlík, kyslík a dusík. Po přečištění je nutné iniciovat rozklad pentakarbonylu. Prvním možným způsobem je nízkotlaký rozklad, druhou možností je tepelný rozklad, tedy zahřátí pentakarbonylu nad 250 °C. Rozkladem vzniká čistý práškový kov, jeho čistota se pohybuje v rozmezí 97,5 – 99,5 %. Vzhledově se jedná o šedý prášek tvořený mikročásticemi.
-
Strukturní vzorec pentakarbonylu železa
Chemicky vysoce čisté karbonylové železo nachází uplatnění v některých průmyslových odvětvích. Kulovitý tvar mikročástic zlepšuje spékací vlastnosti, to se hodí např. při manipulaci s diamantovými nástroji. Speciální magnetické vlastnosti karbonylového železa se uplatňují během výroby indukčních elektronických součástek. Jedinečná mikrostruktura umožňuje absorpci mikrovlnných frekvencí, což je využito v satelitních televizích a mobilních telefonech. Karbonylové železo je mimo jiné složkou některých doplňků stravy.[15][16]
Výroba surového železa
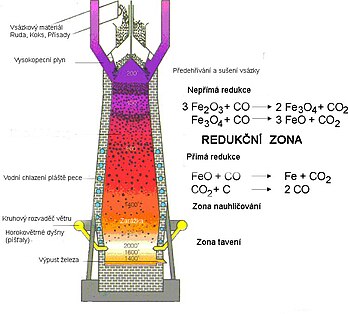
[editovat | editovat zdroj]Surové železo se získává redukcí železné rudy koksem. Vyrábí se z nejrozšířenějších železných rud, převážně z hematitu (Fe2O3), magnetitu (Fe3O4), sideritu (FeCO3) anebo z limonitu (Fe2O3 · x H2O). Kromě železné rudy patří mezi hlavní suroviny pro výrobu železa koks a struskotvorné přísady (nejčastěji se užívá vápenec). Proces výroby probíhá ve vysokých pecích. Vysoká pec, viz obr. 9, dosahuje výšky 25 – 50 m a je rozdělena na 5 sektorů, jedná se o sazebnu (kychtu), šachtu, rozpor, sedlo a nístěj. Teplota ve vysoké peci se v jednotlivých sektorech značně liší, nejvýše dosahuje téměř 2 000°C. Pec pracuje bez výhasu až třicet let. [17][18][19]
Nejdříve je nutné vyrobit koks, který dále ve vysoké peci poslouží nejen jako palivo, ale i redukční činidlo. Příprava koksu spočívá v zahřívání výhradně černého uhlí na teplotu 900 – 1 100 °C, bez přístupu kyslíku. V případě použití hnědého uhlí by nevznikl koks, ale pouze tzv. polokoks, který není pro tyto účely vhodný. Proces výroby v peci nesoucí název koksárenská baterie (koksovací komora), viz obr. 10, trvá přibližně 24 hod. Koksárenské baterie se skládají z komor, které se plní udusaným černým uhlím. Během karbonizace uhlí se uvolňují těkavé plyny, které jsou odsávány a dále se zpracovávají. Vzniklý koks má šedostříbrnou barvu, je tvrdý a pórovitý. Koks se následně zpracovává ve spékárně rud, kde se smísením rozemletého koksu s prachem rudy železa tvoří aglomerační směs. Aglomerační směs je poté spékána do tzv. aglomerátu.[20][21]
Do vysoké pece se shora nepřetržitě vkládá aglomerát a vápenec (vsázka), zároveň je do pece zespod hnán horký vzduch se zvýšeným obsahem kyslíku. Vsázku je nejprve potřeba předehřát a vysušit, zde je teplota okolo 150 °C. První reakcí je spalování koksu, při teplotě téměř 2 000 °C se oxiduje na oxid uhelnatý (CO). Oxid uhelnatý následně, v horní části pece, redukuje železnou rudu na surové železo, proces nese název nepřímá redukce. Současně pracuje přítomný vápenec, jehož úkolem je převedení vznikajících nečistot (převážně oxidů křemíku a vápníku) do strusky. Při nepřímé redukci vzniká oxid uhličitý (CO2), ten reaguje s koksem za vzniku dalšího oxidu uhelnatého. Ve spodní části pece, kde teplota dosahuje 2 000 °C a koks je ve formě taveniny, probíhá přímá redukce. Během přímé redukce je oxid železnatý (FeO) redukován uhlíkem. Po celou dobu se na povrchu taveniny drží vrstva strusky, která je odváděna zvlášť. Struska mimo jiné chrání taveninu železa před oxidací. Struska ve světě nachází uplatnění např. při výrobě tvárnic nebo jako zásypový materiál pozemních komunikací. Surové železo se odvádí ze dna pece, nejedná se o kontinuální proces jako u vkládání vsázky, odpich železa se uskutečňuje v intervalech několika hodin. [1][12][19][22][23][24]
Chemické rovnice reakcí probíhajících ve vysoké peci
Nepřímá redukce
3 Fe2O3 + CO → 2 Fe3O4 + CO2
Fe3O4 + 4 CO → 2 FeO + 4 CO2
Fe2O3 + CO → FeO + CO2
Přímá redukce
FeO + C → Fe + CO
Surové železo obsahuje příměsi, hlavní příměsí je uhlík (standardně 2-4 %), stopově se v něm vyskytuje také P, Si, S a Mn. Jelikož je surové železo tvrdé, křehké a postrádá kujnost, valná většina se dále zpracovává na ocel. Část surového železa se znovu taví v kupolních pecích za vzniku litiny. Litina je slitina železa a uhlíku s obsahem uhlíku větším než 2,14 %. Litina je typická nízkou pružností. Mezi její důležité vlastnosti patří i zvýšená odolnost vůči tlaku a vysoké teplotě. Známe šedou a bílou litinu. Litinu naleznete v praktickém životě v radiátorech a kotlích.
Surové železo obsahuje příměsi, hlavní příměsí je uhlík (standardně 2-4 %), stopově se v něm vyskytuje také P, Si, S a Mn. Jelikož je surové železo tvrdé, křehké a postrádá kujnost, valná většina se dále zpracovává na ocel. Část surového železa se znovu taví v kupolních pecích za vzniku litiny. Litina je slitina železa a uhlíku s obsahem uhlíku větším než 2,14 %. Litina je typická nízkou pružností. Mezi její důležité vlastnosti patří i zvýšená odolnost vůči tlaku a vysoké teplotě. Známe šedou a bílou litinu. Litinu naleznete v praktickém životě v radiátorech a kotlích. [11][17][18][24]
Výroba ocelí
[editovat | editovat zdroj]Ocel se vyznačuje nízkým obsahem uhlíku, maximálně do 2,14 %. Železo s obsahem uhlíku přesahujícím 2,14 % se nazývá litina. Ocel je slitinou železa, uhlíku a případně dalších prvků. Existuje více způsobů převodu surového železa na ocel, nejznámějšími způsoby jsou Bessemerův proces[25], výroba v elektrických pecích a Siemensův-Martinův proces. Mimo jiné se dá připravit recyklací ocelového odpadu. Zkujňování železa (výroba oceli) je založeno nejen na snížení obsahu uhlíku, ale i omezení množství doprovodných prvků (P,S,H,N). Veškerá výroba oceli probíhá v různých typech zkujňovacích pecí.
Nejvíce používaná metoda pro výrobu oceli spočívá ve využití konvertoru[25]. Podstatou konvertoru je profukování (dmýchání) surového železa vzduchem či samotným kyslíkem. Trubky, kterými je vháněn vzduch, případně kyslík jsou z mědi. Uhlík obsažený v železe se naváže na kyslík za vzniku oxidu uhličitého. Oxidy unikají nebo se vážou na vyzdívku pece. Konvertory dělíme podle vyzdívky. Je-li vyzdívka kyselá, jedná se o Bessemerův konvertor, kde se spaluje především křemík. Je-li vyzdívka zásaditá, jde o Thomasův konvertor, v němž se spaluje fosfor, tento děj je pomalejší. V kyslíkovém konvertoru se do surového železa vhání čistý kyslík.
Druhým způsobem přípravy oceli je Siemens-Martinská[25] pec, která disponuje uzavřenou nístějovou pecí (tavným prostorem), palivem pro reakci je koksárenský plyn. Reaguje zde kyslík s křemíkem, křemík se ihned váže na vápník, proto již nepřechází zpět do taveniny. Oxidy železa ze strusky reagují s uhlíkem z taveniny za vznik oxidu uhelnatého. Zkujňování trvá přibližně 10 hodin. Výhodou Siemens-Martinské pece je možná úprava vyzdívky v peci, podle typu surového železa je vyzdívka kyselá či zásaditá.
Elektrické pece se většinou používají k rafinaci ocelí, tedy k dokončení tavby. Ke zkujňování se užívají zřídka. Obloukové elektrické pece mají obvykle zásaditou vyzdívku. Jako zdroj tepla slouží tři uhlíkové elektrody, které spojením s kovovou vsázkou vytváří elektrický oblouk o teplotě až 3 500°C. Výroba oceli v obloukové peci je dražší než v Siemens-Martinské, na druhou stranu je takto vyrobená ocel kvalitnější. V elektrické indukční peci se nachází indukční cívka, která je napájena střídavým proudem, frekvence souvisí nepřímo úměrně s velikostí pece. Existují tedy pece vysokofrekvenční i nízkofrekvenční. Stejně jako trubky konvertoru je i cívka měděná. Hlavní výhodou indukční pece je rychlost tavení. Produkty tohoto procesu nalézají uplatnění při výrobě vysokolegovaných ocelí. [10][12][19][23][25]
Uhlíkaté oceli
[editovat | editovat zdroj]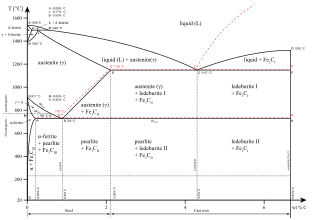
Atomy uhlíku ve struktuře železa zabírají drobné oktaedrické mezery. Uhlíkové oceli jsou podle obsahu uhlíku děleny do tří kategorií. První kategorie, oceli s nízkým obsahem uhlíku (nízkouhlíkové), obsahují do 0,25 % uhlíku, užití nacházejí při výrobě ochranných vrstev, kupříkladu povrch ocelových nádrží. Oceli se středním obsahem uhlíku (středněuhlíkové) se uplatňují při zhotovení strojních součástek, třeba šroubů, matic, svorníku nebo tyčí. Obsah uhlíku u středněuhlíkových ocelí se pohybuje v rozpětí 0,25 % až 0,70 %. Třetí kategorií jsou oceli s vysokým obsahem uhlíku (vysokouhlíkové). Vysokouhlíkové oceli jsou nejvíce odolné vůči korozi, obsahu uhlíku v rozmezí 0,8 % až 1,5 %. Jsou vhodné pro výrobu nářadí sloužícímu k řezání či vrtání. Největším handicapem uhlíkatých ocelí je koroze, korozi předchází aplikace tzv. nátěru kovem, který je vůči korozi odolný. [26]
Na následujícím obrázku je zobrazen fázový diagram Fe/C. Z obrázku jasně vyplývá, že teplota tání železa klesá s rostoucím obsahem uhlíku. Tato tendence pokračuje až po obsah uhlíku 4,3 %, v ten moment je teplota tání nejnižší (1 015 °C), poté opět roste. „Další důležitou zkušeností je vznik různých metastabilních fází umožněný menší rozpustností Fe3C („cementitu“) v železe α, ve srovnání s δ a γ, jejichž existence závisí na tom, s jakou rychlostí se ochlazuje ohřátá ocel.“ (Greenwood a Earnshaw, 1993, str. 1326). Perlit je materiál specifický vlastnostmi měkkost a kujnost, vzniká ochlazením austenitu s obsahem uhlíku do 1 % pod 723 °C. Fyzikální vlastnosti tedy závisí na teplotě a obsahu uhlíku. Ledeburit představuje fázovou směs austenitu a cementitu, jeho krystaly jsou velmi tvrdé a křehké. Karbid triželeza (Fe3C) nese název cementit. Primární cementit je součástí ledeburitu, sekundární nalezneme v perlitu. [1][10][13]
Doplňkové úpravy ocelí
[editovat | editovat zdroj]Oceli je možné dále upravovat, aby byly odolnější, jeden z procesů nese název legování.[27] Legování značně zlepšuje atributy kovů, jedná se o přídavek jednoho či více převážně kovových prvků k uhlíkaté oceli. Legováním vznikají slitinové oceli, setkáme se i s přezdívkou ušlechtilé oceli. Legovací prvek, který se přidává nese odborný název legura. Nejčastěji se používá mangan, molybden, nikl, chrom, vanad a křemík. Dle množství obsažených legur se legované oceli dělí do tří skupin. Nízko legované oceli obsahují do 5 % legur. Středně legované, v nichž obsah legur činí 5 – 10 %. Třetí skupinou jsou vysoce legované oceli, kde obsah legur přesahuje 10 %. Jednou z hlavních výhod legovaných ocelí je delší životnost neboli zvýšená odolnost proti korozi. Legování zlepšuje i mechanické vlastnosti, a to podle příměsi, jednotlivé doprovodné prvky mají vliv na odlišné vlastnosti. Některé zvyšují žáruvzdornost, jiné mají vliv na elasticitu případně na pevnost a tvrdost. Konkrétní účinky jednotlivých legur jsou shrnuty v následující tabulce.[12][26]
| Legující prvek | Specifické vlastnosti |
|---|---|
| Mangan (Mn) | Zvyšuje pevnost oceli, zároveň neovlivňuje plasticitu
Zvyšuje prokalitelnost |
| Chrom (Cr) | Účinkuje proti korozi
Zvyšuje pevnost, tvrdost, prokalitelnost |
| Molybden (Mo) | Zvyšuje žáruvzdornost a odolnost proti vodě
Zvyšuje řezivost a prokalitelnost |
| Nikl (Ni) | Zvyšuje plasticitu a houževnatost
Vysoce toxický – málo užívaný |
| Křemík (Si) | Zvyšuje odolnost proti korozi a žáruvzdornost
Snižuje nízkoteplotní popouštěcí křehkost |
| Vanad (V) | Zvyšuje pružnost a řezivost |
| Hliník (Al) | Zvyšuje odolnost proti korozi a žáruvzdornost |
Další možnou úpravou oceli je kalení. Kalení spočívá v tom, že se ocel zahřeje na předkrystalizační teplotu a poté se prudce zchladí, čímž se zabrání rekrystalizaci. Reakce zvyšuje pevnost oceli v tahu. Uhlíkové oceli se kalí převážně do vody, slitinové do oleje. Čím je obsah uhlíku v oceli vyšší, tím je i tvrdost produktu vyšší.
Mezi úpravy oceli se řadí též popouštění[28], tento proces navazuje na kalení. Účelem popouštění je tepelnou úpravou snížit tvrdost, a hlavně zvýšit houževnatost materiálu. V rámci úprav a zušlechťování oceli, nesmí být opomenuty veškeré nátěry, pokovení a pasivace, které taktéž chrání před korozí.[12]
Koroze
[editovat | editovat zdroj]
Rez jako taková je známá pod vzorcem Fe(OH)3. Jak již bylo naznačeno, koroze je samovolná degradace materiálů. Postihuje nejen velké množství kovů, ale i některé nekovy. Příčinou koroze jsou elektrochemické procesy. Kovy jsou často citlivé na působení atmosférického kyslíku, konkrétně železo koroduje při kontaktu se vzduchem, dochází zde k tvorbě hydratovaného oxidu železitého. Koroze může probíhat i v půdě. Změny způsobené korozí se liší, záleží mimo jiné na době vzájemného působení, hrozí dokonce i úplný rozpad celistvosti. Koroze je vystižena v následující chemické rovnici.[29][30]
4 Fe + 2 H2O + 3 O2 → 2 Fe2O3 · H2O
4 Fe + 2 H2O + 3 O2 → 2 Fe2O3 · H2O
Prvním způsobem třídění mechanismů koroze je rozdělení podle prostředí, v němž probíhá. Atmosférická koroze[31] je nejčastější, postihuje nechráněné výrobky v kontaktu se vzduchem. Kritická vlhkost, při níž začíná železo korodovat se pohybuje okolo 60 %, dále atmosférickou korozi ovlivňují klimatické podmínky, a dokonce i míra znečištění materiálu. Rez se vyskytuje i v kapalném prostředí, obvykle ve vodě. Tato situace se týká například kompresorů, strojů na výrobu páry, vodních potrubí a chladících systémů. Proces koroze ve vodě ovlivňují především kyselost a tvrdost vody, množství obsažených plynů, především kyslíku, neboť jeho přítomnost má vliv na rychlost děje. Mořská voda působí na železo markantněji díky rozpuštěným solím. Koroze probíhá i v půdě, zajímavá je tím, že půda se skládá ze všech tří fází, nejvlivněji působí fáze kapalná. V půdách se setkáváme s tzv. bludnými proudy. Zdroj stejnosměrného proudu, který je v kontaktu se zemí vytváří v půdě katodové a anodové pásmo.[32][33]
Při rozdělení typů koroze podle vnitřního mechanismu existují dva základní typy, chemická a elektrochemická. Chemická koroze vzniká v elektricky nevodivém prostředí. Příčinou poškození je reakce kovového povrchu s látkou vnějšího prostředí, často za zvýšené teploty. Běžně reaguje uhlíkatá ocel v prostředí přehřáté páry. Se vzdušnou vlhkostí roste rychlost procesu.
Galvanická koroze[32] spadá do kategorie elektrochemických korozí, které probíhají v elektricky vodivé kapalině. Jako elektrolyt slouží iontová sloučenina v podobě taveniny nebo roztoku. Během elektrochemických korozí probíhají anodické a katodické reakce. U anodické reakce se z vodiče do elektrolytu přenáší kladný náboj, zatímco u katodické reakce záporný. V případě koroze ve vodě působí obsažený kyslík jako depolarizátor. Galvanická koroze spočívá v tom, že jeden kov koroduje rychleji než druhý, tyto kovy jsou spojené a ponořené ve vodivém roztoku. Katoda, kov s vyšším elektrochemickým potenciálem, koroduje ve spojení pomaleji než za standardních podmínek a kov s nižším elektrochemickým potenciálem (anoda) koroduje rychleji. Dá se říci, že anoda koroduje přednostně. Při spojení například železa a mědi v elektrolytickém roztoku se stává anoda z méně ušlechtilého a více reaktivního železa, úroveň ušlechtilosti kovů se určuje podle Beketovovy řady, která je v upravené verzi na následujícím obrázku. Koroze anody je zrychlená díky rozdílu elektrodových potenciálů, zároveň se inhibuje koroze na katodě. Galvanická koroze v 80. letech dvacátého století atakovala Sochu Svobody, která je na povrchu měděná, ale má železné jádro, které zkorodovalo.[30][31][34]
Sloučeniny železa a jejich využití
[editovat | editovat zdroj]V praxi se nejčastěji setkáme se železem dvojmocným a trojmocným. Pravidelně je možné narazit na železo v oxidačních stavech 0, II, III, IV, VI, eventuálně pak -I, -II. Vzácné je železo v oxidačním stavu V. za tvorby sloučenin reaguje železo ochotně s kyslíkem, halogeny, uhlíkem, dusíkem, sírou, dokonce i s borem. Pro železnaté sloučeniny, tedy sloučeniny, v nichž je železo v oxidačním stavu FeII, jsou typické redukční účinky. Historicky nesly některé železnaté sloučeniny předponu ferro-. Železnaté sloučeniny oxidují působením kyslíku, obzvlášť když se nachází v alkalickém prostředí. Celkově jsou železnaté sloučeniny méně stálé než sloučeniny železité. Četně se vytváří soli s minerálními kyselinami, které krystalizují za vzniku hydrátů. Železité sloučeniny (FeIII) vznikají oxidací železnatých solí. Některé železité sloučeniny se v minulosti skrývaly za předponu ferri-. Utváří soli s majoritním množstvím aniontů, až na ty s redukčními schopnostmi, např. jodidy. Charakteristicky se železité soli vyskytují ve formě hydrátů, nejčastěji se 6 molekulami vody. Hydráty železitých solí se v pevném stavu a v silně kyselých roztocích zbarvují světle růžově.[3][4][5][35][36][37][38]
Oxidy a hydroxidy
[editovat | editovat zdroj]Oxid železnatý[38] (FeO) je černá pyroforická pevná látka. Při teplotě vyšší než 200 K má stejnou strukturu jako NaCl (každý ion je obklopen šesti ionty opačného náboje). Za nižší teploty je oxid železnatý antiferomagnetický. Na vzduchu je stálý za teploty přesahující 575 °C, jinak disproporcionuje na železo a oxid železnato-železitý (Fe3O4). Běžně se získává zahříváním šťavelanu železnatého bez přístupu vzduchu, produkt je nutné rychle zchladit, aby se předešlo rozkladu. Používá se v kosmetice, jako barvivo, zároveň je součástí tetovacích inkoustů.
S oxidem železitým (Fe2O3) se potkáme v mnoha modifikacích, nejvýznamnější jsou formy α a γ. Všechny modifikace jsou nerozpustné ve vodě. Jednotlivé modifikace krystalují v různých strukturách. Červenohnědý hematit (α-Fe2O3) je paramagnetický, získává se termickým rozkladem hydroxidu železitého nebo dusičnanu železitého. Má korundovou krystalickou mřížku, hexagonální těsné uspořádání, v němž kationty vyplňují oktaedrické dutiny. Tato mřížka jej odlišuje od ostatních oxidů železa. Feromagnetický γ-Fe2O3 je metastabilní. Připravuje se opatrnou oxidací Fe3O4. Zahříváním na vzduchu přechází γ-Fe2O3 na α-Fe2O3. Oxid železitý je amfoterní, s kyselinami vytváří soli a s hydroxidy reaguje za vzniku železitanů. Tavením oxidu železitého s oxidy kovů vznikají podvojné oxidy. Uplatnění nachází v potravinovém průmyslu jako barvivo, např. E172, dále se používá jako leštící prostředek. Vyrábí se z něj magnetické pásky.
Oxid železnato-železitý (Fe3O4) je feromagnetický, využívá se k výrobě surového železa. Jeho minerál nese název magnetit. Svým chováním imituje směs FeO a Fe2O3, má strukturu inverzního spinelu. Fe3O4 vzniká ve vakuu zahřátím oxidu železitého na teplotu 1 000 °C. FeO, γ-Fe2O3 a Fe3O4 jsou schopné vzájemného přechodu to je způsobeno podobností krystalických struktur. Všechny tři oxidy krystalizují v nejtěsnějším kubickém uspořádání.
Hydroxid železnatý (Fe(OH)2) je bílá pevná látka, přítomnost kyslíku dodává nazelenalý podtón. Vzniká srážecí reakci, v níž se k roztoku železnatých solí přidává zásada, bílá sraženina je stálá pouze za nepřístupu kyslíku. Jakmile je na vzduchu, tmavne a postupně přechází na hydroxid železitý. Jde o zásaditou látku, která se rozpouští v neoxidujících kyselinách. Hydroxid železnatý není příliš stálý, rozkládá se na Fe3O4 a vodík. Uplatňuje se jako barvivo v potravinách a v kosmetice.
Hydroxid železitý (Fe(OH)3) bývá znám pod triviálním názvem rez. Samovolně vzniká na povrchu některých kovů za přítomnosti kyslíku. Tento červenohnědý prášek není rozpustný ve vodě, je-li čerstvě sražený má amfoterní charakter. Za těchto podmínek je možné ho rozpustit v kyselinách za vzniku železitých solí. Používá se především jako pigment v kosmetice s tetovacích inkoustech. Také se užívá ve stavebnictví, jeho komplexy se uplatňují v lékařství.[3][4][5][35][36][37][38]
| Barva | Teplota tání (°C) | Hustota (g/cm3) | Rozpustný v? | |
|---|---|---|---|---|
| Oxid železnatý | černá | 1 377 | 5,90 | kyseliny |
| Oxid železitý | červenohnědá | 1 565 (rozklad) | 5,24 | kyseliny |
| Oxid železnato-železitý | černá | 1595 (rozklad) | 5,17 | kyseliny |
| Hydroxid železnatý | bílá | rozkládá se | 3,4 | voda (částečně) |
| Hydroxid železitý | červenohnědá | 135 | 4,25 | kyseliny a hydroxidy |
-
Oxid železnatý
-
Oxid železitý
-
Oxid železnatoželezitý
-
Hydroxid železnatý v roztoku
-
Hydroxid železitý
Halogenidy
[editovat | editovat zdroj]V oxidačním stavu FeII+ se železo slučuje se všemi čtyřmi halogeny. Všechny halogenidy dvojmocného železa jsou rozpustné ve vodě a tvoří hydráty. Kromě jodidu železnatého, který vzniká přímým sloučením prvků, vznikají halogenidy železnaté vedením výparů halogenvodíků skrz zahřáté železo. Fluorid železnatý (FeF2) je bílá pevná látka, plyn je monomerní. Světle žlutý chlorid železnatý (FeCl2) má hygroskopické krystalky, plynnou fázi tvoří monomery i dimery. Žlutozeleně zbarvený bromid železnatý (FeBr2). Jodid železnatý (FeI2) se barví tmavě fialově až šedě, je hygroskopický stejně jako FeCl2 a také je citlivý na přítomnost světla. Po rozpuštění jodidu ve vodě vzniká zelený tetrahydrát.
Halogenidy železité vznikají přímým sloučením prvků za působení vysoké teploty. Všechny halogenidy železité tvoří po rozpuštění ve vodě hydráty. Fluorid železitý (FeF3) je světle zeleně zbarvený a nesnadno rozpustitelný ve vodě. Červenohnědý chlorid železitý (FeCl3) se snadno rozpouští ve vodě, za teploty přesahující 300 °C se vyskytuje v podobě dimeru (Fe2Cl6). Hexahydrát chloridu železitého se používá jako leptací prostředek. Leptá mimo jiné měď, což se využívá při výrobě elektrických obvodů. Bromid železitý (FeBr3) je červenohnědé barvy a také je dobře rozpustný ve vodě. Při přípravě FeBr3 je nutné udržet teplotu do 200 °C, jinak by vzniklo FeBr2. FeBr3 tvoří v plynném stavu dimer. Uplatnění nachází jako Lewisova kyselina v organických syntézách. Kvůli redukčním schopnostem aniontu jodu v kombinaci s oxidačními schopnostmi kationtu FeIII+ není možné jodid železitý připravit. [3][4][5][35][36][37][38]
| Barva | Teplota tání (°C) | Hustota (g/cm3) | Rozpustný v? | |
|---|---|---|---|---|
| Fluorid železnatý | bílá | 1100 | 4,09 | ethanol, diethylether |
| Chlorid železnatý | žlutá | 677 | 3,16 | voda, ethanol, aceton |
| Bromid železnatý | zelenožlutá | 684 | 4,63 | voda, methanol, ethanol |
| Jodid železnatý | šedá | 587 | 5,32 | voda |
| Fluorid železitý | zelená | >1000 | 3,87 | voda, polární rozpouštědla |
| Chlorid železitý | hnědá | 306 | 2,90 | voda, polární rozpouštědla |
| Bromid železitý | hnědá | 200 | 4,50 | voda |
-
Fluorid železitý
-
Chlorid železnatý
-
Chlorid železitý
Sulfidy
[editovat | editovat zdroj]
Sulfid železnatý[4] (FeS) je černá krystalická látka, související s výrobou sirovodíku (sulfanu). Na vzduchu se snadno oxiduje až na síran. Vzniká přímým sloučením prvků anebo reakcí sulfidu amonného s roztoky železnatých solí. Ve zředěných kyselinách se rozpouští za vzniku sulfanu (H2S).
Žlutý minerál pyrit neboli disulfid železnatý (FeS2) připravíme zahřátím oxidu železitého v atmosféře H2S. tuto diamagnetickou sloučeninu tvoří ionty FeII+ a S2II-. Zahřívá-li se pyrit ve vakuu, vzniká sulfid železnatý a síra, zatímco zahřátím na vzduchu se připravuje oxid železitý a oxid siřičitý, viz rovnice reakcí níže.
FeS2 → FeS + S
FeS2 → FeS + S
4 FeS2 + 11 O2 → 2 Fe2O3 + 8 SO2
Sulfid železitý (Fe2S3) je nestálou černou pevnou látkou, která se rozkládá za standardní pokojové teploty na sulfid železnatý a disulfid železnatý.
Železnaté a železité soli
[editovat | editovat zdroj]Síran železnatý[38] (FeSO4) je známý především jako heptahydrát aneb zelená skalice (FeSO4·7 H2O). Krystaly na vzduchu ztrácí vodu, jejich barva se postupně mění na žlutohnědou. V dehydratovaném stavu se síran železnatý vyskytuje jako bílá pevná látka. V praxi se uplatňuje jako vločkovací činidlo během čištění odpadních vod, slouží jako doplněk stravy při anémii. V minulosti se pro svou barevnost používal jako inkoust.
Připravuje se reakcí železa se zředěnou kyselinou sírovou.
Síran železnato-amonný[38] ((NH4)2Fe(SO4)) obvykle krystalizuje z vodných roztoků se šesti molekulami vody jako Mohrova sůl, tedy hexahydrát síranu železnato-amonného ((NH4)2Fe(SO4)2·6 H2O). Krystalky Mohrovy soli jsou obvykle světle zelené s lehkým namodralým nádechem. Mohrova sůl je vůči oxidaci kineticky více stálá než ostatní soli.
Uhličitan železnatý (FeCO3) se vyskytuje v podobě bílé sraženiny, která na vzduchu oxiduje, působením oxidace hnědne. Uhličitan železnatý není rozpustný ve vodě, ačkoliv je-li ve vodě přítomen rozpuštěný CO2, rozpouští se a přechází na hydrogenuhličitan železnatý (FeHCO3). V této formě se s ním setkáme v pramenitých vodách.
Síran železitý (Fe2(SO4)3) se vyrábí rozpuštěním Fe2O3 v koncentrované kyselině sírové. Je zbarven bíle až béžově. Krystalizuje z vodných roztoků s šesti různými počty molekul vody (12, 10, 9, 7, 6, 3), nejběžnější je však nonahydrát síranu železitého (Fe2(SO4)3·9 H2O), sloužící jako koagulační činidlo při čištění odpadních vod, používá se také jako činidlo k potlačení zápachu kanalizace. Na nonahydrát v šesterečné soustavě je možné narazit v přírodě. Druhým hydrátem vyskytujícím se v přírodě je dekahydrát síranu železitého (Fe2(SO4)3·10 H2O), jehož soustava je jednoklonná.
Dusičnan železitý[4] (Fe(NO3)3) krystaluje ve dvou možných podobách, jako hexahydrát a nonahydrát. V bezvodé stavu je bílý až světle fialový, hydráty mají oranžovou barvu. Připravuje se reakcí zředěné kyseliny dusičné s kovovým železem, v případě přílišného zředěn kyseliny vzniká i vedlejší produkt, dusičnan amonný. Za zvýšené teploty podléhá disproporcionaci na oxid železitý a oxid dusičitý.
Fosforečnan železitý (FePO4) je za běžných podmínek ve vodě nerozpustný žlutý prášek. Ve vodném roztoku se samovolně mění na komplexní fosfatoželezitany bílé barvy. Fosfatoželezitany jsou snadno rozpustné ve vodě. Fosforečnan železitý se používá jako insekticid.
Octan železitý (Fe(CH3COO)3) je červenohnědá prášková sůl obsahující ligand oxidu. Používá se jako barvivo. Glukonát železnatý je železnatou solí vznikající neutralizací kyseliny glukonové. Používá se v lékařství pro léčbu anémie, v potravinářství se s ním setkáváme pod kódem E579, kde upravuje barevnost. Při předávkování je toxický, poškozuje sliznici střev a žaludku, má dopad i na jiné orgány. Šťavelan železnatý ((COO)2Fe) je žlutý prášek, který se špatně rozpouští ve vodě. Vytváří dihydrát, jehož struktura je pospojována šťavelanovými můstky. Zahřátím degraduje na směs oxidů a práškové železo. [3][4][5][35][36][37][38]
| Barva | Teplota tání (°C) | Hustota (g/cm3) | Rozpustný v? | |
|---|---|---|---|---|
| Síran železnatý | bílá | 70,0 | 3,35 | voda, methanol |
| Síran železnato-amonný | modrozelená | 100 | 1,86 | voda |
| Uhličitan železnatý | žlutohnědá | rozkládá se | 3,70 - 3,90 | nerozpustný |
| Síran železitý | světle hnědá | 480 (rozklad) | 3,14 | methanol |
| Dusičnan železitý | světle růžová | 47,0 | 1,68 | voda, ethanol, aceton |
| Fosforečnan železitý | světle žlutá | 1000 | 2,87 | kyselina chlorovodíková |
-
Bezvodý síran železnatý
-
Heptahydrát síranu železnatého
-
Bezvodý síran železnato-amonný
-
Hexahydrát síranu železnato-amonného, Mohrova sůl
-
Bezvodý síran železitý
-
Uhličitan železnatý
-
Uhličitan železitý
-
Hexahydrát dusičnanu železnatého
-
Pentahydrát fosforečnanu železitého
Koordinační sloučeniny železa
[editovat | editovat zdroj]Železo se v koordinačních sloučeninách nevyskytuje s vyšším oxidačním číslem než +III. V oxidačním čísle +II je prokázána existence mnoha komplexů s mnoha ligandy, avšak stabilita těchto komplexů nedosahuje výše stability železitých komplexů. Příčinou je menší náboj kationtu. Komplexy železa uplatňují svůj význam i na půdě biochemie, jako příklad poslouží hemoglobin a transferin. Více o funkci železa v živých organismech viz kapitola Biochemie železa.
![Strukturní vzorec [Fe(phen)3]2+](http://upload.wikimedia.org/wikipedia/commons/thumb/6/6d/Komplex_Fe.png/220px-Komplex_Fe.png)
Železnaté komplexy bývají běžně oktaedrické, přesto vytváří některé anionty tetraedrické prostorové uspořádání. Tetraedrické uspořádání [FeX4]2- potkáme u chloridu, bromidu a jodidu. Hexakyanoželeznatanový anion ([Fe(CN)6]4-) neboli ferrokyanid není za běžných podmínek toxický, ale při rozkladu ve zředěných kyselinách uniká HCN. Železnatý ion se dále slučuje například s dusíkem za tvorby [Fe(NH3)6]2+, což není s kationtem FeIII+ realizovatelné.
Železitý kation upřednostňuje kyslíkové donory před dusíkovými. Zároveň se setkáváme i s komplexy, kde se vyskytují jak kyslíkové, tak dusíkové atomy, příkladem je EDTA. S amoniakem tvoří Fe3+ nestabilní komplexy, které ve vodě rozkládají. Železité komplexy preferují oktaedrické uspořádání, vyskytují se však i ve formě tetraedrické, nejdůležitějším tetraedrickým železitým komplexem je FeCl4-. Oktaedrické koordinační sloučeniny se dělí na vysokospinové a nízkospinové. Mezi vysokospinové oktaedrické komplexy se železem v oxidačním stavu III+ patří [FeF6]3-; [Fe(H2O)6]3+ a [Fe(ox)3]3-. V rámci nízkospinových železitých komplexů se setkáme s [Fe(CN)6]3- nebo s [Fe(phen)3]3+. Výjimkou, v níž jsou stabilnější železnaté komplexy jsou koordinační sloučeniny chelátotvorných ligandů. Jako příklad poslouží vysoká stálost bordového [Fe(phen)3]2+ ve vodném roztoku, zatímco tmavě modrý [Fe(phen)3]3+ tvoří ve vodě polymerní hydroxo-částice, jejichž vlivem dochází ke změně barvy na zelenohnědou.[3][4][5][35][36][37][38]
Organokovové sloučeniny
[editovat | editovat zdroj]Pentakarbonyl železa[4] ([Fe(CO)5]) vzniká reakcí zahřátého práškového železa s oxidem uhelnatým. Za standardních podmínek je pentakarbonyl železa žlutou kapalinou. Jeho struktura je trigonálně bipyramidální, železo ve struktuře obklopuje pět molekul oxidu uhelnatého. Molekula je diamagnetická a charakteristická svou vysokou toxicitou a těkavostí, také je nerozpustná ve vodě.
Pentakarbonyl železa je tzv. proměnlivá molekula, která díky své struktuře podléhá Berryho pseudorotaci. Jedná se o vibraci způsobující schopnost pentakarbonylu železa měnit své geometrické uspořádání výměnou dvou ligandů v axiální pozici za dva ekvatoriální. Jeden z karbonylových ligandů se neúčastní poziční výměny, karbonyly v axiální i ekvatoriální pozici mění svůj vazebný úhel a vzdálenost mezi vazbami, přechodným stavem je čtvercová pyramida. Vzápětí se zvětšuje vazebný úhel mezi původně ekvatoriálními ligandy až po úhel 180 °. Pro lepší představu se dá pseudorotace přirovnat k nůžkám, axiální ligandy představují svírající se nůžky, které procházejí vznikající mezerou v otevírajících se nůžkách ekvatoriálních ligandů. Molekula během tohoto procesu nijak nerotuje, odtud název pseudorotace.


Ferrocen (C10H10Fe) aneb bis(cyklopentadienyl) železnatý je organokovová sloučenina žlutooranžového zbarvení. Ferrocen se řadí mezi metaloceny, vytváří je všechny prvky 3d skupiny. Strukturně se jedná o tzv. sendvičový komplex (viz obr.), který je typický umístěním kovu doprostřed mezi dva paralelní cyklopentadienové kruhy. Při vyšší než pokojové teplotě ferrocen sublimuje a zároveň ho nijak neovlivňuje vzduch, voda ani zásadité látky. Ferrocen se rozpouští v organických rozpouštědlech, ve vodě je nerozpustný. Podléhá acylačním reakcím a elektrofilní substituci. Ferrocen je stálý na vzduchu i ve vodě, není toxický. Pro svou specifickou strukturu se ferrocen používá například jako součást palivových aditiv a nejrůznějších léků.
Objev ferrocenu byl zcela náhodný a podařilo se tak na přelomu 40. a 50. let dvacátého století hned dvěma badatelským skupinám. Vědci z firmy British Oxygen Company se snažili modifikovat Haberův proces a vytvořit aminy přímým sloučením dusíku s uhlovodíky. Při jednom z experimentů reagoval cyklopentadien s železem přítomným v aparatuře za vzniku oranžové krystalické látky, ferrocenu. Druhý tým pracoval na přípravě fulvalenu II, nechal zreagovat Grignardovu sloučeninu (cyklopentadien) s chloridem železitým, opět vznikla oranžová krystalická látka. Tým se rozhodl látku dále analyzovat. Nová sendvičová struktura byla odvozena třemi týmy, ulehčila pochopení vysoké stability metalocenů. Tento objev byl významný především, protože odstartoval zájem chemiků o organokovovou chemii jako takovou. [4][36]
| Barva | Teplota tání (°C) | Hustota (g/cm3) | Rozpustný v? | |
|---|---|---|---|---|
| Pentakarbonyl železa | žlutá | -20 | 1,45 | organická rozpouštědla |
| Ferrocen | žlutooranžová | 174 | 1,49 | organická rozpouštědla |
Využití železa
[editovat | editovat zdroj]Technické železo je nejpoužívanější kov, používá se především jako konstrukční materiál. Ve formě čistého železa však nemá mnoho uplatnění. Železo vytváří slitiny s mnoha prvky, nejvíce využívané jsou oceli. Různé typy ocelí se používají například v automobilovém průmyslu jako materiál k výrobě karoserie, dveří, některých částí motoru, narazíme na ni i v interiéru automobilů. Řada domácích spotřebičů se vyrábí z oceli, jako příklad poslouží lednice, trouba nebo dřez. V domácnosti používáme i ocelové příbory či hrnce. Ocel nachází uplatnění i ve šperkařství, z chirurgické oceli se vyrábí náušnice, řetízky a náramky. [1][39]
Komponenty z oceli jsou obsaženy i v solárních, vodních a větrných elektrárnách. Dále se z ocelí vyrábí kolejnice, chirurgické náčiní a implantáty, konstrukce obráběcích strojů, v neposlední řadě se využívá i jako stavební materiál. Z některých sloučenin železa se vyrábí barviva, keramické glazury, polovodiče dokonce i desinfekční prostředky. Sloučeniny mohou posloužit též jako katalyzátor reakcí v rámci organické i anorganické chemie. Jednoduše řečeno, železo a jeho slitiny nachází uplatnění ve většině průmyslových odvětví, následující obrázky jsou toho důkazem. Na levém obrázku je zobrazen ocelový žebřík v horách a vedle něj plachetnice, jejíž trup je částečně vyroben z korozivzdorných ocelí. [26]
- Kde všude se můžeme v běžném životě setkat s ocelí
-
Loď (konstrukce lodí jsou v současnosti většinou z laminátu, pořád se ale některé části vyrábí z ocelí)
-
Ocelový žebřík
-
Židle s ocelovou konstrukcí
-
Omáčník
-
Příbor z oceli (konkrétně nerezová ocel viz využití niklu)
-
Trouba
-
Chirurgické nářadí
-
Kolejnice
-
Rytířské brnění
-
historické zbraně
Železo ve stavebnictví
[editovat | editovat zdroj]
Vynález železobetonu si nechal ve druhé polovině 19.století patentovat francouzský zahradník Joseph Monier, který vyráběl květináče se železným pletivem, aby zamezil jejich prasknutí v zimních měsících. Objev zapříčinil revoluci ve stavebnictví. Železobeton[40][41] je stavební konstrukce složená z betonu a ocelových prvků. Železo či ocel slouží v konstrukci jako betonářská výztuž, jelikož samotný beton má pevnost pouze v tlaku, přidané železo zvyšuje jeho odolnost v tahu. Pro konstrukce je důležité, aby měla ocel stejnou tepelnou roztažnost jako beton, v opačném případě hrozí zborcení při tepelných změnách. Tyče kruhového průřezu s příčnými vruby na povrchu se mohou používat zvlášť ve formě tzv. roxorů anebo se svařují dohromady a tvoří kari sítě. Ze železobetonu se skládají základové desky budov, stěny a stropy domů, také se z něj vyrábí konstrukce mostů, sloupy, patníky na silnicích bránící autonehodám a mnoho dalších.[42][43]
V mnoha zemích se rapidně rozvíjí trend ocelových staveb, nejen pro její estetické a ekonomické přednosti, ale i z ekologického hlediska. Moderní architektura využívá odolnosti, tvárnosti a snadného svařování oceli. Hlavní výhodou oceli je stoprocentní recyklovatelnost, dále umožňuje vznik velkých otevřených prostor a zároveň není výstavba ocelových struktur náročná ani časově. Z oceli se vyrábí sloupy nesoucí veřejné osvětlení, ploty, zábradlí, schodiště, žebříky, mosty a jiné. Také se můžeme setkat se stavbami či podpěrnými sloupy z oceli. Příkladem ocelových budov je Agrobanka v Brně z roku 1995, jejíž interiér tvoří z velké části ocel a sklo nebo odbavovací hala brněnského letiště s ocelovým stropem. [44]
Nástrojová ocel
[editovat | editovat zdroj]Z oceli se vyrábějí mimo jiné i nástroje. Jelikož se většinou jedná o nářadí, musí mít nástrojová ocel pevný povrch, některé typy potřebují být odolné vůči teplu, jiné houževnaté nebo korozivzdorné. Specifické legury dodávají specifické vlastnosti, oceli se číslují dle norem. Do skupiny nástrojových ocelí patří uhlíkaté oceli, legované oceli, rychlořezné oceli, případně i oceli slitinové. Rychlořezné nástroje musí být velmi tvrdé, z toho důvodu se legují nejčastěji molybdenem či wolframem. Dále se nástrojová ocel používá k opracování kamene a těžbě hornin, vyrábí se z ní ruční nářadí, licí formy, měřidla, chirurgické nástroje a další.
Reaktivita železa
[editovat | editovat zdroj]Železo je v práškové formě reaktivní, pyroforický kov. Po zahřátí reaguje s kovy i nekovy. Má afinitu ke kyslíku, reakcí s kyslíkem tvoří tři různé oxidy (železnatý, železitý a železnato-železitý). Je dobře rozpustné ve zředěných kyselinách, reakcí vznikají železnaté soli a vodík. Výsledky reakcí s koncentrovanými kyselinami se liší. Například s koncentrovanou kyselinou dusičnou či sírovou nereaguje, nýbrž se pasivuje. Pokud však reaguje se zahřátým roztokem zředěné kyseliny dusičné, vznikají soli železité. Reakcí s taveninou alkalického kovu reaguje při teplotě přesahující 400 °C viz reakce níže, vznikají tak alkalické železany. [45]
Biochemie železa
[editovat | editovat zdroj]Železo je nejdůležitějším biogenním stopovým prvkem v lidském těle, je pro nás esenciální. V těle dospělého jedince se nachází přibližně 4 – 4,5 g železa. Více než 60 % tohoto množství využívá hemoglobin během transportu kyslíku. Železo nachází uplatnění ve valné většině biochemických drah. Základními funkcemi bílkovin obsahujících železo jsou transport a uskladnění kyslíku a také transport elektronů. Část železa v těle je součástí enzymu, až 30 % celkového množství je ukryto do zásoby ve formě ferritinu nebo hemosiderinu. Železo není důležité pouze pro živočichy, ale i pro rostliny. Je jednou z klíčových surovin pro tvorbu chlorofyly, bez něj listy žloutnou a postupně umírají, zároveň se účastní nejrůznějších procesů látkové výměny. [46][47][48]
Fe + 2 KOH + 3 KNO3 → K2FeO4 + 3 KNO2 + H2O
Ukládání a transport železa
[editovat | editovat zdroj]Železo přijaté v potravě je nezbytné přepravit do hemoglobinu. V žaludku se absorbují železnaté kationty (FeII+), v krvi se transformují do metaloproteinu transferinu, který obsahuje kationty FeIII+. Transferin je nutné transportovat někam, kde budou zásoby připravené k použití. U savců se železo ukládá převážně do jater, kostní dřeně a sleziny. Ve slezině nalezneme železo v podobě ve vodě rozpustného ferritinu. Transferin se řadí mezi glykoproteiny, u člověka přináší denně do kostní dřeně až 40 mg. Polypeptidový řetězec transferinu vytváří dvě kapsy vhodné pro vazbu FeIII+ iontů. [46][47][48]
Přenos kyslíku
[editovat | editovat zdroj]
Kyslík je tělem savců transportován krevním řečištěm pomocí bílkoviny hemoglobin, která se nachází v červených krvinkách. Hemoglobin zajišťuje červenou barvu erythrocytů. Ve tkáních předává hemoglobin kyslík imobilnímu myoglobinu, v této podobě je kyslík uložen. Ve svalech je kyslík vázaný na myoglobin připraven k uvolnění energie metabolickou oxidací glukosy, při níž vzniká oxid uhličitý, který se následně transportuje krevním řečištěm zpět do plic. Jelikož hemoglobin i myoglobin obsahují železo, řadí se mezi hemové bílkoviny. Hemové bílkoviny, protože jejich součástí je tzv. hem, ten se skládá z části proteinového řetězce zvané porfyrin a z na něm navázaného FeII+. Zajímavé je, že „V hemoglobinu, ve kterém není koordinována molekula O2, je železo přítomno v podobě vysokospinového FeII. Reverzibilním připojením O2 přechází FeII na diamagnetický, nízkospinový stav, aniž přitom dochází ke změně oxidačního čísla.“ (Greenwood a Earnshaw, 1993, str. 1357). [11]
| Název bílkoviny | Funkce | Organismus | |
|---|---|---|---|
| Hemové proteiny | hemoglobin | přenos kyslíku | živočichové |
| myoglobin | uskladnění kyslíku | živočichové | |
| cytochromy | přenos elektronů | rostliny, živočichové | |
| Nehemové proteiny | transferin | zachycení železa | živočichové |
| ferritin | uskladnění železa | živočichové | |
| feredoxiny | přenos elektronů | bakterie, rostliny | |
| hemerytrin | přenos kyslíku | živočichové |
Cytochromy
[editovat | editovat zdroj]Cytochromy jsou membránové proteiny obsahující ve své struktuře hemové jednotky. Hemové jednotky zde obstarávají přenos elektronů, plní tedy hlavní funkci cytochromů. Atom železa ve všech cytochromech je stejně jako v hemoglobinu a myoglobinu koordinován k porfyrinovému skeletu. Hned vedle, na šestém koordinačním místě se majoritně nachází atom síry, který svými silnými donorovými schopnostmi podporuje inzerci atomu železa. Cytochromy přenáší elektrony během oxidace glukosy. V průběhu oxidace glukosy se uplatňují cytochromy a, b, c, díky tomu roste redukční potenciál. Vznikající redoxní gradient zapříčiňuje, že se energie ukládá do ATP (adenosintrifosfátu). [48]
Onemocnění
[editovat | editovat zdroj]Krevní anémie neboli chudokrevnost je onemocnění spočívající v nedostatku železa v těle. Vede k tělní slabosti a zvýšené únavě. Léčba anémie se zakládá na požívání tablet obsahujících železnaté případně železité soli. Výhodou železnatých solí je lepší rozpustnost ve fyziologickém pH, naproti tomu železité soli nejsou ve vodném prostředí náchylné oxidaci. Mezi konkrétní příklady sloučenin užívaných k doplnění železa patří síran železitý, chlorid železitý, fumarát železnatý a sukcinát železnatý. Při podání příliš velkého množství železa není možné tento nadbytek z těla vyloučit. [11][46][47][48]
Kobalt
[editovat | editovat zdroj]Kobalt, jakožto druhý prvek triády železa má ve valenční sféře elektronovou konfiguraci 3d7 4s2. Stejně jako železo se ve sloučeninách typicky vyskytuje spíše v nižších oxidačních stavech, +II, +III. Kobalt je tvrdší než železo. Modrý nádech kobaltu se již od pradávna používal při barvení keramiky. Nejstarší nálezy pocházejí ze starověkého Egypta, z doby cca 2 600 let př.n.l. Díky své rezistenci vůči korozi nachází kobalt uplatnění v úpravě vlastností různých slitin, například legování ocelí. Dále se využívá v lékařství či v elektrotechnice. [11][49]
Fyzikální a chemické vlastnosti
[editovat | editovat zdroj]Kobalt je feromagnetický kov stříbrolesklé barvy, vyznačuje se namodralými tóny. Vyznačuje se tvrdostí a pevností, která předčí oceli. Kobalt má pouze jeden stabilní izotop 59Co[49], jedná se tedy o monoizotopický prvek. Feromagnetický je pouze do teploty 1 120 °C, za vyšších teplot je paramagnetický. Hranice ztráty se feromagnetických vlastností se nazývá Curieův bod, kobalt má z prvků triády železa nejvyšší Curieův bod. Kobalt taje za teploty 1 495 °C, do plynného stavu přechází při přesažení teploty 2 780°C.
Kobalt disponuje dvěma alotropickými modifikacemi, α-kobalt a β-kobalt. První modifikací je α-kobalt, který krystaluje v hexagonální těsné mřížce (HCP). Tato alotropická modifikace je stabilní za standardních teplot, až po teplotu 417 °C, při dosažení přechází na β-modifikaci. Druhá modifikace, β-kobalt, krystaluje v kubické plošně centrované mřížce (FCC). Jelikož je přechod mezi modifikacemi pomalý, je možné přidáním několika procent železa zajistit existenci β-kobaltu za pokojové teploty.
Stejně jako v případě železa jsou nejčastější a nejstabilnější nízké oxidační stavy, především +II a +III. Jejich elektronová konfigurace je d7 a d8. Kvůli oxidačním vlastnostem kobaltitého iontu se vyskytuje jen pár sloučenin v oxidačním stavu +III. V komplexních sloučeninách oxidační číslo +III naopak zcela dominuje.
Elementární kobalt je ušlechtilejší než elementární železo. Za pokojové teploty je málo reaktivní. Po zahřátí se slučuje s nekovy, působením vysoké teploty reaguje s kyslíkem. Na vzduchu je na rozdíl od železa stálý, charakteristicky při teplotě přes 900 °C na vzduchu shoří. V kyselinách se rozpouští, ale má-li kyselina oxidační účinky, povrch kobaltu se pasivuje a tím se rozpouštění zpomaluje. Zajímavé je, že nereaguje s dusíkem a vodíkem.[3][11][49]
Výskyt v přírodě
[editovat | editovat zdroj]Oproti železu je rozšíření kobaltu v přírodě minimální (25 ppm), v Zemské kůře zaujímá až třicáté místo. Zastoupení v mořské vodě či ve vesmíru není taktéž nijak významné. V přírodě nenarážíme na naleziště kobaltu jako takové, standardně se těží spíše nikl a kobalt se v rudě objevuje jako doprovodný prvek. Stejně tak se kobalt vyskytuje i v rudách mědi a olova. Kobalt je součástí více než dvou set minerálů, nejdostupnější jsou arsenidy a sulfidy. Vyskytuje se v následujících rudách niklu: smaltin (CoAs2), kobaltin (CoAsS) a linnéit (Co3S4). Kobalt se tedy získává jako vedlejší produkt při výrobě jiných kovů. [50]

Výroba kobaltu
[editovat | editovat zdroj]Vzhledem k tomu, že je kobalt většinou doprovodným prvkem v rudě jiného kovu, získává se stejně tak jako vedlejší produkt při výrobě jiných kovů. Kobalt se nejčastěji získává zpracováním rud niklu, mědi a olova, obvykle je přítomen ve formě arsenidu. Při extrakci kobaltu z rud jiných kovů hraje důležitou roli koncentrace kobaltu a celkové složení rudy. Vesměs se rudy nejdříve praží, během tohoto procesu je oddělena struska od směsi kovu a různých oxidů. Míšeň je typicky zbarvená do červena, proto se místy nazývá safor. Jedná-li se o rudu niklu, další krok spočívá v rozpuštění míšně v kyselině sírové, roztavené železo se následně odstraňuje srážením vápnem, kobalt se vylučuje vlivem chlornanu sodného (NaClO). Vzniklá sloučenina se tepelnou úpravou převede na oxid, ten se redukuje na kov. V případě rud olova či mědi se míšeň luhuje v kyselině chlorovodíkové, vzápětí se sráží sulfanem. Poté se opět působí chlornanem sodným. [7][8][51]
Metody výroby kobaltu
[editovat | editovat zdroj]Jedna z metod získává kobalt ze smíšených sulfidů mědi a kobaltu. Metoda se zakládá na pražení rudy ve fluidní peci, kde se sulfid převádí na rozpustné sírany, pokud obsahuje ruda i železo, to se mění na hematit, který je nerozpustný. Produkty pražení se luhují v kyselině sírové, postupně se odstraňují jednotlivé příměsi, přidáním vápna se vysráží měď, poté se směs opět luhuje. Závěrem vzniká hydroxid kobaltnatý, který se převádí na kov elektrolýzou.
Možnou úpravu strusky poskytuje sulfidizace, s jejíž pomocí se přeměňují oxidy a sulfidy mědi, kobaltu a železa na samotné kovy. Tímto způsobem se ošetřuje směs vzniklá pražením a následným elektrolytickým louhováním za přítomnosti tzv. sulfidátoru. Jako sulfidátor slouží síran vápenatý nebo sulfid vápenatý. Sulfidizace[52] je popsána v následujících reakcích.
CoFeO2 + CaSO4 + 2 C → CoS + FeO + CaO + 2 CO2
CoS + FeO → CoO + FeS
CoO + Fe → Co + FeO
Sherrittův proces[53] je hydrometalurgická metoda získávání kobaltu ze sulfidických rud obsahujících kobalt a nikl. Ruda se opět praží a extrahuje, kobalt se sráží vysokotlakým vodíkem. Následně se kobalt redukuje vodíkem v autoklávech, přístrojích konstruovaných pro vysokotlaké a vysokoteplotní reakce. Hydrometalurgické procesy, probíhají v kapalině, v tomto případě ve vodě za teploty vyšší než teplota varu vody, autoklávy umožňují průběh reakce.
Dále se kobalt získává z lateritových anebo arsenidových rud. Příprava z lateritových rud vyžaduje hydrometalurgické roztavení a následnou separaci složek. Arsenidové rudy se praží, čímž se eliminuje těkavý arsen v podobě oxidu, následuje úprava kyselinou chlorovodíkovou nebo sírovou a přečištění hydrometalurgickými procesy. Kobalt se extrahuje elektrorafinačním srážením, případně se s uhličitanem kobaltnatým zahřeje na teplotu 400 °C za vzniku oxidu uhličitého a kobaltnatého, který se na kov převádí redukcí. [3][52][53]
Sloučeniny kobaltu a jejich využití
[editovat | editovat zdroj]Kobalt vytváří sloučeniny v rozmezí oxidačních stavů od -I po +V. Nejvíce rozmanité jsou sloučeniny dvojmocného a trojmocného kobaltu, kobaltnaté sloučeniny převládají. Byl prokázán výskyt sloučenin v oxidačních stavech +IV a +V, nicméně tyto sloučeniny nejsou příliš časté. Například oxid kobaltičitý (CoO2) vytváří soli kobaltičitany, nicméně ani oxid ani jeho soli nejsou stabilní. Sloučeniny s vyšším oxidačním číslem kobalt netvoří vůbec. Jak již bylo zmíněno, jednoduché sloučeniny preferují oxidační stav +II, komplexní +III. [3][4][6][35][36][49]
Oxidy a hydroxidy
[editovat | editovat zdroj]Oxid kobaltnatý (CoO) má olivově zelenou barvu. Disponuje stejnou krystalickou strukturou jako chlorid sodný. Připravuje se prudkým zahříváním hydroxidu kobaltnatého bez přístupu vzduchu, hydroxid se v reakci rozkládá. Místo hydroxidu je možné zahřívat uhličitan nebo dusičnan. Za standardní teploty je feromagnetický. Oxid kobaltnatý je za standardních teplot stálý, zahřátím na 600 – 700 °C za přítomnosti vzduchu se mění na oxid kobaltnato-kobaltitý černé barvy. Při vyšších teplotách přechází zpět na oxid kobaltnatý a je opět stálý. Pigmenty vznikající žíháním nachází uplatnění v keramickém průmyslu.
Oxid kobaltitý (Co2O3) má nižší iontovost než oxid kobaltnatý, z toho důvodu je méně bazický. Není rozpustný ve vodě, rozpouští se ve zředěné kyselině sírové. Sloučenina je teoreticky nestabilní, zdaleka není tolik známá jako oxid kobaltnatý a oxid kobaltnato-kobaltitý. V kyselém roztoku působí jako silné oxidační činidlo.
Oxid kobaltnato-kobaltitý (Co3O4) je černá pevná látka, která se při překročení teploty 900 °C se rozkládá. Má spinelovou strukturu stejně jako oxid železnato-železitý, ve skutečnosti se jedná o Co2+Co 3+
2 O4. Kationty kobaltnaté a kobaltité zaplňují tetraedrické i oktaedrické mezery v mřížce. Sousedící částice mají opačné spiny, proto je látka antiferomagnetická. Oxid kobaltnato-kobaltitý se připravuje zahřátím oxidu kobaltnatého, jak již bylo zmíněno.
Hydroxid kobaltnatý[54] (Co(OH)2) existuje ve dvou formách. Čerstvá modrá sraženina se postupem času mění na stabilnější růžovou formu. Rozpouští se v kyselinách za vzniku kobaltnatých solí, ve vodě je rozpustný minimálně. Jelikož se amfoterní, po zahřátí je rozpustný i v koncentrovaných hydroxidech. V elektrotechnice se uplatňuje při výrobě elektrod do Li-ion akumulátorů, dále slouží jako sušidlo do barev a inkoustů. [3][4][6][35][36][49]
| Barva | Teplota tání (°C) | Hustota (g/cm3) | Rozpustný v? | |
|---|---|---|---|---|
| Oxid kobaltnatý | olivově zelená | 1795 | 6,43 | kyseliny |
| Oxid kobaltitý | červenočerná | 895 | 5,18 | kyselina sírová |
| Oxid kobaltnato-kobaltitý | černá | 900 (rozklad) | 6,05 | kyseliny, hydroxidy |
| Hydroxid kobaltnatý | modrá, růžová | 168 (rozklad) | 3,60 | kyseliny, hydroxidy |
Halogenidy
[editovat | editovat zdroj]Fluorid kobaltnatý (CoF2) je růžová pevná látka, která krystaluje v rutilové struktuře. Ve vodě je málo rozpustný, ve vroucí vodě se rozkládá. Tvoří několik hydrátů, které se rozpouští ve vodě, nejvíce rozpustné jsou dihydrát a trihydrát. Významný je tetrahydrát (CoF2·4 H2O) červeného zbarvení s ortogonálním uspořádáním mřížky. Fluorid kobaltnatý se používá při výrobě kovů nebo jako katalyzátor při legování.
Silně hydroskopický chlorid kobaltnatý (CoCl2) má v bezvodém stavu světle modrou barvu. S hydratací postupně mění vzezření přes různé odstíny fialové k červenorůžovému zbarvení. Červenorůžový je v podobě hexahydrátu (CoCl2·6 H2O). Krom toho se vyskytuje jako dihydrát a tetrahydrát. Díky svým barevným přechodům slouží jako indikátor vlhkosti v silikagelu. Také se používá k inhibici koroze, výrobě kobaltnatých sloučenin a při výrobě pneumatik[55] se uplatňuje jako pojivo pryžové směsi a ocelových pásků.
Bromid kobaltnatý (CoBr2) nacházíme také více různých barvách. Bezvodá forma je zelená. Zbarvení hydratovaných forem se liší, dihydrát je modrofialový, hexahydrát červený. Bromid kobaltnatý se připravuje reakcí kobaltu s plynným bromem. V roztoku vznikají koordinační sloučeniny.
Jodid kobaltnatý (CoI2) má zelenočernou barvu a vrstevnatou strukturu jodidu kademnatého. Krystalizuje v podobě červeného hexahydrátu. Připravuje se sloučením práškového kobaltu s parami jodu za zvýšené teploty. Z roztoků vznikají komplexy (jodokobaltnatany).
Fluorid kobaltitý (CoF3) je jediný binární halogenid kationtu Co3+. Bezvodá forma je hygroskopická a má hnědou barvu, ve stavu hydratovaném se barva změní na zelenou, jedná se o pentahydrát (CoF2·5 H2O). Fluorid kobaltnatý je ve vodě rozpustný, zároveň se v ní rozkládá. Uplatňuje se jako oxidační a fluorační činidlo, v organických syntézách. Byl syntetizován i chlorid kobaltitý (CoCl3), nicméně je vysoce nestabilní. Bromid a jodid kobaltnatý nebyly doposud připraveny. [3][4][6][35][36][49]
| Barva | Teplota tání (°C) | Hustota (g/cm3) | Rozpustný v? | |
|---|---|---|---|---|
| Fluorid kobaltnatý | růžová až červená | 1 217 | 4,46 | kyseliny, voda |
| Chlorid kobaltnatý | modrá | 730 | 3,35 | voda, aceton, ethanol, benzonitril |
| Bromid kobaltnatý | zelená | 678 | 4,91 | voda, ether, ethanol, aceton |
| Jodid kobaltnatý | zelenočerná | 515 | 5,58 | voda, ethanol, aceton |
| Fluorid kobaltitý | hnědá | 927 | 3,88 | voda |
-
Fluorid kobaltnatý
-
Bezvodý chlorid kobaltnatý
-
Bezvodý chlorid kobaltnatý
-
Hexahydrát chloridu kobaltnatého
-
Bromid kobaltnatý
-
Fluorid kobaltitý
Kobaltnaté soli
[editovat | editovat zdroj]Síran kobaltnatý (CoSO4) je bílá krystalická látka. Síran kobaltnatý tvoří mnoho hydrátů. Nejlépe se ve vodě rozpouští heptahydrát. Šarlatově červený heptahydrát síranu kobaltnatého (CoSO4·7 H2O) je známý pod názvem červená či kobaltnatá skalice. Další hydráty obsahují jednu nebo šest molekul vody. Při jeho přípravě se ve zředěné kyselině sírové rozpouští buď uhličitan kobaltnatý nebo oxid kobaltnatý. Prakticky se používá ke galvanickému pokovování, k výrobě sulfidu kobaltnatého, který slouží jako inkoust.
Dusičnan kobaltnatý (Co(NO3)2 je v bezvodé i hydratované podobě červeně zbarvený. Tvoří tři hydráty, dihydrát, tetrahydrát a nejčastěji se setkáme s hexahydrátem. Ohřátím disproporcionuje za vzniku oxidu kobaltnatého, oxidu dusičitého a kyslíku.
Uhličitan kobaltnatý (CoCO3) není na rozdíl od ostatních solí rozpustný ve vodě. Má růžovočervené zbarvení a je náchylný k tvorbě podvojných solí. Srážením Co2+ soli se získávají uhličitany zásaditých parametrů. Tyto uhličitany se barví do modra. Uhličitan kobaltnatý je součástí modrých glazur a zároveň se používá jako doplněk stravy.
Octan kobaltnatý (Co(CH3COO)2) je červenou solí kyseliny octové. Vytváří tetrahydrát (Co(CH3COO)2· 4 H2O) charakteristický růžovým zbarvením. Je hygroskopický, postupně se za přítomnosti vzdušné vlhkosti rozpouští ve vodě. Bezvodá varianta se uplatňuje jako katalyzátor, podílí se na přípravě mnohých materiálů (komplexy, mazadla, barviva). Tetrahydrát v zanedbatelném množství obohacuje krmivo dobytka, podporuje příjem vitaminu B12. [3][4][6][35][36][49]
| Barva | Teplota tání (°C) | Hustota (g/cm3) | Rozpustný v? | |
|---|---|---|---|---|
| Dusičnan kobaltnatý | červená | 100 (rozklad) | 2,49 | voda, nepolární rozpouštědla |
| Síran kobaltnatý | bílá | 735 | 3,71 | voda, ethanol |
| Uhličitan kobaltnatý | růžovočervená | 427 | 4,13 | methanol |
| Tetrahydrát octanu kobaltnatého | růžová | 140 | 1,71 | vody, ethanol, pyridin, zředěné kyseliny |
-
Heptahydrát síranu kobaltnatého
-
Hexahydrát dusičnanu kobaltnatého
-
Uhličitan kobaltnatý bezvodá forma
-
Tetrahydrát octanu kobaltnatého
Další sloučeniny
[editovat | editovat zdroj]Sulfid kobaltnatý (CoS) je černý prášek s červenými podtóny. Ve vodě ani v hydroxidech se nerozpouští, rozpustný je pouze v kyselinách. Používá se jako katalyzátor.
Kyanid kobaltnatý (Co(CN)2) Ochotně tvoří komplexní sloučeniny (kyanokobaltnatany), rozpouští se v amoniaku, není rozpustný ve vodě ani v kyselinách. Kyanokobaltnatany přechází za zvýšené teploty na kyanokobaltitany. Slouží jako prekurzor pro přípravu oktakarbonylu dikobaltu. [36]
Koordinační sloučeniny
[editovat | editovat zdroj]Kobalt ochotně tvoří koordinační sloučeniny jak ve stavu +II, tak ve stavu +III. Vzniká i několik komplexů v oxidačním stavu +IV, víceméně se jedná o sloučeniny s fluorem nebo smíšenými oxidy kobaltu. Pro nedostatečnou chemickou čistotu se komplexy kobaltičité v praxi příliš nepoužívají. Komplexy kobaltu v oxidačním stavu +III jsou kineticky inertní, to znamená, že jejich příprava často spočívá v pouhé oxidaci CoII+ sloučenin. Valná většina komplexů trojmocného kobaltu je nízkospinová s oktaedrickou strukturou. Kobaltité komplexy disponují afinitou k dusíkatým ligandům, jejich běžnou součástí je amoniak, nitro skupina, či jiné formy vázaného dusíku. Kobaltité komplexy obsahující amoniak jsou známé svou stálostí na vzduchu i ve vodě a vyskytují se v nejrůznějších barvách, zástupců je nespočet.
Chlorid kobaltitý tvoří s amoniakem hned několik komplexů. Na těchto sloučeninách objevil švýcarský chemik Alfred Werner pravdivou strukturu komplexů s koordinačním číslem šest. Vyvrátil tak mylnou hypotézu organických chemiků, podle nichž by byly atomy koordinačních sloučenin vázány pevnou kovalentní vazbou. Ve skutečnosti obsahují komplexní sloučeniny alespoň jednu koordinačně-kovalentní vazbu, též známou pod názvem donor-akceptorová. Vazbu odlišuje způsob vzniku, donorový atom má volný elektronový pár, jež poskytne akceptornímu atomu, který elektrony postrádal. Za sestavení modelu struktury těchto sloučenin získal Alfred Werner v roce 1913 Nobelovu cenu za chemii. Strukturu určil za pomoci srážení komplexů v dusičnanu stříbrném, viz reakce níže.
[Co(NH3)6] + 3 AgNO3 → 3 AgCl + [Co(NH3)6](NO3)3
[Co(NH3)5Cl]Cl2 + 2 AgNO3 → 2 AgCl + [Co(NH3)5Cl](NO3)2
Ve struktuře oktaedrického komplexu je centrální atom přechodného kovu (kobaltu) obklopen šesti ortogonálními ligandy (v tomto případě aminy) a zároveň i třemi záporně nabitými chloridovými ionty. Spolu s objevem struktury zavedl A. Werner i správný zápis. A. Werner ve svém výzkumu objevil dvě různě barevné varianty chloridu tetraammin-dichlorokobaltitého ([Co(NH3)4Cl2]Cl), přišel na rozdílné uspořádání ligandů a rozdělil izomery na cis-formu fialové barvy a zelenou trans-formu.
Mezi nejznámější komplexy kobaltité patří chlorid hexaamminkobaltitý ([Co(NH3)6]Cl3, jehož barva je oranžová se žlutým nádechem nebo červený chlorid pentaammin-aquakobaltitý ([Co(NH3)5(H2O)]Cl3. Hexanitrokobaltitany ([Co(NO2)6]3-) jsou další stabilní dusíkaté koordinační sloučeniny kobaltu. Barevně jsou převážně žluté nebo oranžové. Také se můžeme setkat s hexakyanokobaltitany ([Co(CN)6]3-). Sloučeniny s kyslíkem nedosahují až na výjimky takové stálosti.
Stabilita kobaltnatých komplexů je nižší než u kobaltitých a také podléhají oxidaci. Co do počtu, dvojmocný kobalt tvoří méně komplexů než trojmocný. Stechiometrie je různá, často se jedná o oktaedrické komplexy, ale je možné narazit i na tetraedrické či čtvercové, dokonce existují i CoII+ komplexy s koordinačním číslem pět. Mezi karboxyláty kobaltnaté patří například octan ([Co(OOCCH3)2]·4 H2O) červeného zbarvení. Tetraedrické komplexy s aniontem [CoX2]2-, kde X představuje halogen, mívají modrou barvu. [3][4][6][35][36][49]
Organokovové sloučeniny
[editovat | editovat zdroj]Čistý oktakarbonyl dikobaltu (Co2(CO)8) je zbarven do běla, většinou mají však krystaly oranžový nádech. V molekule se nachází dva atomy kobaltu v oxidačním stavu nula, atomy obklopuje osm karbonylových ligandů. Uspořádání karbonylů se může lišit, existuje více izomerů. Oktakarbonyl dikobaltu se ve vodě nerozpouští. [4][36]
Využití kobaltu
[editovat | editovat zdroj]Soli dvojmocného i trojmocného kobaltu se barví modře, občas červeně. Již od starověkého Říma se kobalt pro své výrazné barvy používal ve sklářském a keramickém průmyslu jako barvivo. Dnes slouží mimo jiné jako bělidlo k optické kompenzaci žlutých podtónů. Díky inertnímu chování vůči atmosféře či vodě se uplatňuje ke galvanickému pokovování méně ušlechtilých kovů. Kobalt je součástí katodového materiálu[56] lithium-iontových akumulátorů (Li-ion), které se díky své vysoké měrné kapacitě v poměru s hmotností používají například v elektromobilech. [49]
Slitiny
[editovat | editovat zdroj]Kobalt dodává ocelím pevnost, tvrdost a zvyšuje jejich odolnost. V metalurgii se používá jako legovací prvek. Slitina kobaltu se zlatem, tzv. modré zlato, se uplatňuje ve šperkařství. Také je součástí superslitin, které se skládají z chromu, wolframu, titanu, hliníku, niklu a kobaltu, ale neobsahují významnější množství železa. Superslitiny nepodléhají korozi a jsou odolné vůči vysokým teplotám. Využívají se kupříkladu v plynových turbínách a v letadlových motorech.
Slitina prvků triády železa, hliníku a mědi poskytuje permanentní magnety, které jsou 25krát silnější než standardní ocelové magnety. Samarium, prvek ze skupiny lanthanoidů, tvoří ve slitině s kobaltem ještě silnější magnet. Takto silné magnety zachovávají stálé magnetické pole v elektromotorech. Všechny magnetické slitiny kobaltu disponují teplotní stabilitou, jejich Curieův bod odpovídá zhruba 800 °C.
Práškový kobalt reaguje spékáním s karbidem wolframu za vzniku slinutého karbidu, vlastnosti slitiny určuje poměr obsaženého kobaltu a wolframu. Slinuté karbidy jsou velmi tvrdé a odolné i za vyšších teplot, těmito vlastnostmi předčí rychlořezné oceli. Ze slinutých karbidů se vyrábí vrtáky, frézy a soustružnické nože. [12][57]
Zdroj radioaktivního záření
[editovat | editovat zdroj]Již bylo zmíněno, že má kobalt jediný stabilní izotop 59Co. Zároveň má kobalt dohromady třicet radioizotopů. Poločas rozpadu mnohých radioizotopů je v řádech vteřin, minut anebo hodin. Stabilnější z nich se přeměňují po dvou měsících až po půl roce, ku příkladu 56Co, 57Co a 58Co. Je-li izotop 59Co ozařován energetickými neutrony vzniká nestabilní radioizotop 60Co. Díky rozpadu jader 60Fe je možné na 60Co narazit i v přírodě. Poločas přeměny 60Co lehce přesahuje pět let (5,27 let), přičemž se uvolňuje vysoce energetické gama záření. Kvůli tomu byla v minulosti idea využít radioizotop jako součást vnějšího pláště jaderných bomb. Součástí pláště by byl stabilní izotop 59Co, který by se při výbuchu přeměnil na radioaktivní 60Co.
Pro snadnou přípravu se 60Co používá v medicínské radioterapii při ozařování nádorových tkání gama zářením. Ozařovací přístroj nese název kobaltové dělo. Dále se používá ke sterilizaci nástrojů a jako zdroj záření v nejrůznějších průmyslových odvětvích. V defektoskopii slouží k identifikaci vnitřních vad v různých materiálech. [49]
- Kde všude se můžeme v běžném životě setkat s kobaltem
-
Vitamin B12
-
Li-ion baterie
-
lithium-iontová baterie
-
Ocelové vrtáky legované kobaltem
Reaktivita kobaltu
[editovat | editovat zdroj]Protože je kobalt ušlechtilejší kov než železo, je na vzduchu stálý. V kyselinách se standardně rozpouští, pokud však mají oxidační vlastnosti, k rozpuštění nedochází, nýbrž se kobalt pasivuje na povrchu. V silných kyselinách vyjma kyseliny dusičné se postupně rozpouští, reakcí vzniká kobaltnatá sůl a vodík. Zahřátím na alespoň 300 °C startuje reakce s kyslíkem, během níž vzniká smíšený oxid kobaltnato-kobaltitý, pokračuje-li se k 900 °C oxiduje se na oxid kobaltitý. S nekovy se slučuje po zahřátí, konkrétně se jedná o bor, uhlík, fosfor a síru. S vodíkem a dusíkem kobalt nereaguje. Tavením s hydroxidy kovů alkalických zemin se připravují různobarevné kobaltitany. [11][35][49]
Biochemie kobaltu
[editovat | editovat zdroj]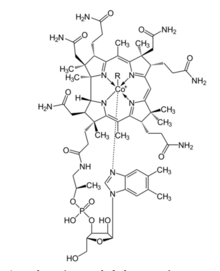
Kobalt tvoří centrální atom vitaminu B12 (kobalamin). Je v něm komplexně vázán společně se čtyřmi koplanárními dusíky z pyrrolů do porfyrinového skeletu. Šesté koordinační místo obsazuje atom uhlíku, jedná se tedy o organokovovou sloučeninu. Uspořádání se podobá struktuře hemu. Vitamin B12 je žlutooranžová diamagnetická látka významná tím, že je jeden z mála organokovů, který nalezneme v přírodě. Pro člověka je esenciální, v těle jsou uloženy zásoby vitaminu B12, přibližně 2 – 5 mg. Tělo ho vstřebává v části tenkého střeva zvané ileum, endocytózou se dostane do enterocytů, putuje do jater, kde je uložen do zásoby.
Vitamin B12 sehrává důležitou roli v krvetvorbě, tvorbě nukleových kyselin, vývoji CNS u dětí a mimo jiné má anabolické účinky. Podílí se na metabolismu cukrů, tuků a bílkovin. [49]
Onemocnění
[editovat | editovat zdroj]Má-li jedinec málo kobaltu v těle, typickým projevem je zvýšená únava, nechutenství a hubnutí. V chronických případech se nedostatek kobaltu projevuje anémií, ztrátami paměti, v nejhorším případě až částečnou paralýzou či roztroušenou sklerózou. Doplnění kobaltu je možné léky, v potravě na něho narazíme v mléčných výrobcích, v mase a vejcích. V listové stravě na vitamin B12 narazíme pouze ve fermentovaných produktech, například v pivě nebo v kysaném zelí.
Organismus se může kobaltem i otrávit. Přijímáme ho v potravě, dokonce i vdechujeme s prachem a aerosoly. Otrava se neprojevuje okamžitě, trvá to obvykle několik týdnů. Dlouhodobé vdechování prachu může vést k dýchacím potížím připomínajícím astma, v horších případech hrozí plicní fibróza. Dalšími onemocnění spojenými s toxicitou kobaltu jsou polycytémie a hyperplazie štítné žlázy. [11][35][49]
Nikl
[editovat | editovat zdroj]Nikl je třetím a posledním prvkem triády železa. Nalezené rudy niklu běžně obsahují kobalt a jiné příměsi. Objev niklu jako takového byl učiněn německým chemikem Axelem Frederikem Cronstedtem až v polovině 18.století. Snažil se o izolace mědi z rudy nesoucí název nikelin, svým načervenalým zbarvením připomínala oxid měďný. Koncem 18.století se začaly razit mince z ryzího niklu.
Přes pozdní objev sahá historie předmětů vyrobených z niklu staletí před náš letopočet ve starověké Číně a na území dnešní Sýrie. Je tomu tak, protože se tehdy používaly různé slitiny jejichž součástí byl i nikl. Nikl je zastoupen i ve vesmíru, konkrétně v meteoritech. Meteority tvoří slitina železa a niklu, množství niklu se liší. Když obsahuje meteorit více než 18 % niklu, nazývá se ataxit. Zároveň se předpokládá vysoký obsah niklu v Zemském jádře.
Jelikož na vlhkém vzduchu nepodléhá korozi, uplatňuje se jako antikorozní ochrana jiných kovů. Slitiny niklu mají široké uplatnění. Využívá se k legování ocelí, ze slitin s mědí se razí mince. Používá se v elektrotechnice například při výrobě galvanických článků.[3][4][8][58][59]
Fyzikální a chemické vlastnosti
[editovat | editovat zdroj]Nikl má stříbřitě bílou barvu, jedná se o kujný a tažný kov. Taje při teplotě 1 455 °C, do plynného stavu přechází za teploty 2 913 °C. Elektronová konfigurace valenční sféry je 3d8 4s2. Nikl je za pokojové teploty stejně jako ostatní prvky triády železa feromagnetický, při dosažení teploty 363 °C (Curiova bodu) tuto vlastnost ztrácí. Za standardních podmínek je vzhledem ke vzduchu a vodě zcela inertní. Prášková forma niklu je pyroforická. Nikl disponuje vysokou elektrickou i tepelnou vodivostí.
Ve sloučeninách se nikl vyskytuje v nižších oxidačních stavech, chemie sloučenin niklu není příliš bohatá. Nejvyšší možný oxidační stav ve sloučeninách je +IV, nejnižším stavem je -I, setkáváme se ním u organokovových sloučenin. Nejčastější oxidační stav je stejně jako u předchozích +II. Sloučeniny v oxidačním stavu +III se na vzduchu mnohdy rozkládají, rozkladu podléhají i ve vodě. Stejně tak ani v rámci koordinačních sloučenin není rozmanitost oxidačních stavů velká. Většina komplexů má oxidační stav +II, existují ale i na vzduchu stabilní sloučeniny +III, +IV.
Stejně jako předchozí prvky není nikl v kompaktním stavu příliš reaktivní. Po zahřátí se slučuje s borem, křemíkem, fosforem, sírou a halogeny. S fluorem probíhá reakce mírněji než se zbylými halogeny. Zahřejeme-li nikl do podoby červeného žáru, oxiduje se vodní parou. [3][7][8][58][59]
Izotopy niklu
[editovat | editovat zdroj]Nikl má pět stabilních izotopů. Nejběžnější je izotop 58Ni, jehož zastoupení dosahuje téměř 70 %. Dalšími izotopy jsou 60Ni zastoupen 26,22 %, 62Ni (3,63 %), zbylé dva stabilní izotopy 61Ni a 64Ni jsou zastoupeny okolo jednoho procenta. Nikl má také 28 radioizotopů, většina z nich má poločas rozpadu do deseti sekund, některé však vydrží relativně dlouho. Například 56Ni má poločas rozpadu 6,07 dne a vyskytuje se v supernovách. 63Ni je stabilní po dobu 101 let a vůbec nejstabilnějším radioizotopem je 59Ni s poločasem rozpadu 76 000 let. Tento izotop pro svou dlouhotrvající přeměnu nachází uplatnění v izotopové chemii při stanovení pozemského stáří meteoritů. Zajímavý je radioizotop 48Ni, který má pouze 20 neutronů a 28 protonů, jelikož se jedná o tzv. dvojitě magický nuklid, jeho stabilita je tak mnohem vyšší, než se předpokládalo. Protonové i neutronové číslo odpovídá plně zaplněným slupkám ve slupkovém modelu jádra, proto je vazebná energie jádra značně zvýšená. [3][58]
Výskyt v přírodě
[editovat | editovat zdroj]Nikl je sedmý nejrozšířenější přechodný kov v přírodě. Koncentrace v zemské kůře dosahuje 100 ppm, řadí se na 22. pozici. Zastoupení odpovídá zhruba čtyřnásobku výskytu kobaltu v Zemské kůře. Ve vesmíru je dle předpokladů zastoupen v poměru s atomy vodíku 1:700 000. Je možné narazit na nikl i v ryzí formě, meteoritická slitina se železem. Spousta rud niklu vzniká ultramafickým zvětráváním. Jde o magmatické horniny, které se (v tomto případě) skládají majoritně z olivínu. Afinita niklu ke kyslíku a k síře či k arsenidu vede k následujícímu rozdělení. První skupinou jsou laterity neboli kyslíkaté rudy, které vždy vznikají zvětráváním ultramafických plášťových hornin. Zvětraliny často obohacuje železo a hliník. Konkrétními rudami jsou zelený garnierit obsahující silikáty a limonit, který v příměsích obsahuje i nikl. Garnierit má složitou strukturu, v níž obsahuje kromě niklu i hořčík, křemík, hliník a železo. Používá se k výrobě niklu.
Druhou skupinou jsou sulfidické rudy, ve kterých se vyskytuje sulfid nikelnato-železitý. Pentlandit (Ni,Fe)9S8 má poměr niklu a železa 1:1, ten může být pozměněn vlivem inkluzí. Pentlandit je křehký a tvoří izomerické krystaly, barevně představuje nažloutlý lesklý bronz. Všechny sulfidické minerály mají podobný vzhled, snadno se pletou. Pentlandit se odlišuje převážně tím, že není magnetický. Hojně se vyskytuje v ultramafických horninách. Mezi sulfidické rudy patří ještě millerit (NiS). Jedná se o jehlicovitý minerál mosazného zbarvení, jehož agregáty připomínají hrst psích chlupů.
Do skupiny sulfidických rud se řadí i arsenidové rudy. Nejvýznamnější ruda nikelin (NiAs) obsahuje v příměsích síru, železo a kobalt. Struktura nikelinu je složena ze submřížek, z primitivní hexagonální niklové a těsné hexagonální arsenové. Na každý atom niklu působí oktaedrická koordinace spojující nikl se šesti atomy arsenu. Dalšími arsenidovými rudami jsou smaltin ((Ni,Co,Fe)As2) a sdorfit (NiAsS). [58][60][61]
-
Laterická ruda niklu - garnierit
-
Jehlicovitý millerit
-
Pentlandit
Výroba niklu
[editovat | editovat zdroj]Proces výroby niklu je velmi složitý a metody jsou různé, vždy se odvíjí od typu rudy. Historicky se k výrobě používaly převážně sulfidické rudy, v dnešní době se vyrábí nikl i z lateritických rud. Rudy niklu se zpracovávají pyrometalurgickými technikami. Obecný postup při výrobě niklu spočívá v následujících krocích. Nejdříve je nezbytné převést rudu na sulfid niklu, ten se reakcí s kyslíkem v konvertoru praží na směs oxidu nikelnatého (NiO) a oxidu siřičitého (SO2). V posledním kroku redukujeme oxid nikelnatý uhlíkem na kovový nikl. Postup je zaznamenán v následujících rovnicích.
Výroba niklu z garnieritu využívá jeho afinitu k síře. Nejdřív se ruda taví, vzniká struska křemičitanů. Poté se praží v konvertoru s křemenem, aby se odstranilo nežádoucí železo. Vyrábí-li se nikl z pyrrhotinu, opět se snižuje obsah síry pražením a následně je potřeba odstranit měďnatý. Sulfidy vzniklé pražením se taví s koksem v šachtové peci. Efektem tavení je, že sulfid mědnatý se drží na povrchu, zatímco sulfid nikelnatý se usazuje na dně. Tavenina se chladí, vrstvy se od sebe oddělí. Dalším pražením vzniká surový nikl s obsahem 1 – 2 % mědi. Surový nikl se následně čistí karbonylovým způsobem nebo se elektrolyticky rafinuje. [3][7][60]
2 Ni3S2 + 7 O2 → 6 NiO + 4 SO2
NiO + C → Ni + CO
Karbonylový způsob
[editovat | editovat zdroj]K získání vysoce čistého niklu slouží příprava karbonylovým způsobem. Metoda se nazývá Mondův proces, jehož kroky jsou sepsány v následujících reakcích. Reakcí surového niklu s nadbytkem oxidu uhelnatého za teploty pouhých 50 °C a standardního tlaku vzniká těkavý a plynný tetrakarbonyl niklu (Ni(CO)4). Následným zahřátím na alespoň 200 °C se tetrakarbonyl rozkládá na nikl a oxid uhelnatý. Čistota vzniklého niklu přesahuje 99,90 %. Mondův proces využívá jednoduchosti vzniku karbonylového komplexu oproti ostatním kovům.
Ni + 4 CO → Ni(CO)4
Ni(CO)4 → Ni + 4 CO
Alternativní postup poskytuje výroba tetrakarbonylu přímo ze sulfidu niklitého působením oxidu uhelnatého. Tento proces však vyžaduje vyšší teplotu i tlak. Elektrolytická rafinace představuje další možnost přečištění niklu. Používá se pro čištění surového niklu obsahujícího platinu. Čistota výsledného produktu dosahuje 99,99 %. [1][59][62]
Sloučeniny niklu
[editovat | editovat zdroj]Nejvíce rozmanitou chemii poskytují sloučeniny dvojmocného niklu. Jak již bylo zmíněno v podkapitole o fyzikálních vlastnostech, sloučeniny vyšších oxidačních stavů než +II nejsou stálé na vzduchu ani ve vodě, v obou případech se rozkládají. Nikelnaté soli anorganických kyselin se ve formě hydrátů až na výjimky barví zeleně. Bezvodé soli mají různé zbarvení. Čtyřmocný nikl je vzácný, pro vznik těchto sloučenin jsou zapotřebí silná oxidační činidla. [3][7][35][59][62]
Oxidy, hydroxidy a sulfidy
[editovat | editovat zdroj]Oxid nikelnatý (NiO) zelené barvy má stejnou strukturu jako chlorid sodný (ionty jsou obklopeny ionty opačného náboje). Touto strukturou disponují i oxid kobaltnatý a oxid železnatý. Stechiometrie oxidu nikelnatého prokazuje přítomnost kationtu niklitého ve struktuře. Zahřátím oxid nikelnatý žloutne. Rozpouští se v kyselinách, ale není rozpustný ve vodě. Jedná se o amfoterní látku, která se připravuje termickým rozkladem (dehydratací) hydroxidu nikelnatého nebo uhličitanu nikelnatého. Používá se v keramickém průmyslu k barvení.
Oxid niklitý (Ni2O3) má šedou až černou barvu. Rozpouští se pouze v kyselinách. Vzniká při pomalé oxidaci uhličitanu nikelnatého za teploty 300 °C.
Hydroxid nikelnatý (Ni(OH)2) tvoří zelené krystalky. Dá se vysrážet z vodných roztoků nikelnatých solí. Rozpouští se v kyselinách a roztocích amoniaku.
Sulfid nikelnatý (NiS) je černý prášek. V přírodě se vyskytuje jako minerál millerit. Existuje ve dvou formách. Při teplotách vyšších než 379 °C je stabilní α-NiS, za nižších teplot ke stabilní β-NiS.Za čerstva se sulfid nikelnatý rozpouští v kyselinách, jinak je zcela nerozpustný. Nerozpustný, protože přechází na Ni(OH)S. [3][4][35][36][59][62]
| Barva | Teplota tání (°C) | Hustota (g/cm3) | Rozpustný v? | |
|---|---|---|---|---|
| Oxid nikelnatý | zelená | 1 970 | 6,67 | kyseliny a amonné soli |
| Hydroxid nikelnatý | zelená | 230,0 | 4,10 | kyseliny a amonné soli |
| Sulfid nikelnatý | černá | 797,0 | 5,87 | Za čerstva v kyselinách |
Halogenidy
[editovat | editovat zdroj]Dvojmocný nikl se slučuje se všemi čtyřmi halogenidy. Jejich barva v bezvodém stavu odpovídá žluté nebo tmavě hnědé až černé. Fluorid nikelnatý (NiF2) vytváří tetragonálí krystaly, které krystalují v rutilové struktuře. Ve vodném roztoku krystaluje jako trihydrát. Fluorid nikelnatý slouží jako katalyzátor při přípravě pentafluoridu chloru. Trojmocný nikl se slučuje s fluorem, fluorid niklitý je však velmi nečistý. Existuje i fluorid nikličitý, ale ten není stálý nad teplotou – 68 °C.
Chlorid nikelnatý (NiCl2) se v bezvodém stavu vyskytuje jako hygroskopická klencové struktury. Ve vodném roztoku vznikají tři různé hydráty, dihydrát, tetrahydrát a hexahydrát. Dihydrát se barví hnědožlutě, tetrahydrát žlutozeleně a hexahydrát má zelené krystaly. Dihydrát se získává částečnou dehydratací hexahydrátu. Chlorid nikelnatý se připravuje přímým sloučením prvků. Chlorid nikelnatý společně se svými hydráty nachází uplatnění jako Lewisova kyselina v organické syntéze.
Bromid nikelnatý (NiBr2) má v bezvodém stavu strukturu stejnou jako CdCl2. Vytváří hydráty se dvěma, třemi anebo šesti molekulami vody. Pravděpodobně je karcinogenní. Hydratované formy mají zelenou barvu. Používá se v organické syntéze a k přípravě katalyzátorů.
Jodid nikelnatý (NiI) má černou barvu, jeho krystalická struktura je stejná jako u CdCl2. Vytváří modrozelený hexahydrát. Bezvodý jodid se připravuje taktéž přímým sloučením prvků. Používá se v homogenní katalýze. [3][4][35][36][59][62]
| Barva | Teplota tání (°C) | Hustota (g/cm3) | Rozpustný v? | |
|---|---|---|---|---|
| Fluorid nikelnatý | žlutá | 1 474 | 4,72 | částečně ve vodě |
| Chlorid nikelnatý | zlatožlutá | 1 009 | 3,51 | voda, ethanol, glycerol, diethylether |
| Bromid nikelnatý | hnědožlutá | 963,0 (sublimuje) | 5,10 | voda |
| Jodid nikelnatý | černá | 780,0 | 5,38 | voda, alkoholy |
-
Fluorid nikelnatý
-
Hexahydrát chloridu nikelnatého
-
Bromid nikelnatý
-
Hexahydrát jodidu nikelnatého
Nikelnaté soli
[editovat | editovat zdroj]Síran nikelnatý (NiSO4) má žlutou barvu a hygroskopické vlastnosti. Jedná se o paramagnetickou, karcinogenní a dráždivou látku, používající se k pokovování. Z vodného roztoku krystaluje v podobě hydrátů. Známější je hexahydrát síranu nikelnatého (Ni(SO4)·6 H2O) tyrkysové barvy, tvoří i heptahydrát. Hexahydrát má dvě modifikace, v rozmezí okolo 30 – 50 °C je stabilní modrozelená a při přesahu 53,3 °C druhá modifikace, ta se barví zeleně. Za pokojové teploty vzniká tzv. nikelnatá skalice neboli zelený heptahydrát (Ni(SO4)·7 H2O).
Dusičnan nikelnatý (Ni(NO3)2) se za laboratorních podmínek vyskytuje pouze v hydratované podobě. Standardně vytváří zelený hexahydrát Ni(NO3)2·6 H2O, silné oxidační činidlo. Pomalým zahříváním přechází hexahydrát nejprve na tetrahydrát (4 H2O) a po dosažení teploty 45 °C vzniká dihydrát (2 H2O). Bezvodá forma existuje při teplotách v rozmezí 125 – 145 °C. Následným ochlazením může vznikat nonahydrát (9 H2O). V keramickém průmyslu slouží jako pigment, v barvířském jako mořidlo.
Dusitan nikelnatý (Ni(NO2)2). V roztoku má tendenci vytvářet komplexní nitronikelnatany. Krystaluje ve formě hydrátů, které se barví do červenohněda. Další sloučeninu představuje thiokyanatan nikelnatý (Ni(SCN)2) žlutohnědé barvy, který se zastarale nazývá rhodanid nikelnatý. Za nízké teploty je antiferomagnetický.
Uhličitan nikelnatý (NiCO3) je název označující různé sloučeniny, které mají ve své struktuře uhličitanový anion a nikl. Nejdůležitější uhličitan nikelnatý se skrývá pod vzorcem (Ni4CO3(OH)6(H2O)4. Existuje i forma hexahydrátu. Ve vodných roztocích kyselin hydrolyzuje, žíháním přechází na oxid nikelnatý. Uhličitan nikelnatý disponuje mírnou toxicitou, není vhodné být v dlouhodobém kontaktu. Uplatnění nachází v keramickém průmyslu a jako prekurzor katalyzátorů.
Octan nikelnatý (Ni(CH3COO)2) oktaedrické struktury vytváří ve vodném roztoku dihydrát a tetrahydrát. Vodné roztoky jsou známé pro svou nasládlou chuť, soli octanu dráždí kůži a jsou karcinogenní. [3][4][7][35][36][59][62]
| Barva | Teplota tání (°C) | Hustota (g/cm3) | Rozpustný v? | |
|---|---|---|---|---|
| Síran nikelnatý | žlutá | 100 | 3,68 | voda |
| Hexahydrát dusičnanu nikelnatého | zelená | 56,7 | 2,05 | voda, ethanol |
| Dusitan nikelnatý | modrozelená | 220 (rozklad) | 8,90 | voda |
| Thiokyanatan nikelnatý | žlutohnědá | rozkládá se | 1,13 | voda |
| Uhličitan nikelnatý | zelená | 205 (rozklad) | 4,39 | nerozpustný |
| Octan nikelnatý | tyrkysová | rozkládá se zahřátím | 1,80 | voda, methanol, kyselina octová |
-
Hexahydrát síranu nikelnatého
-
Hexahydrát dusičnanu nikelnatého
-
Uhličitan nikelnatý
-
Tetrahydrát octanu nikelnatého
-
Struktura octanu nikelnatého
Koordinační sloučeniny
[editovat | editovat zdroj]Chemie koordinačních sloučenin niklu se rozpíná v rozmezí oxidačních stavů od 0 po +IV. S komplexy NiIV se setkáváme výjimečně. Některé jsou stabilní alespoň na vzduchu, ve vodě všechny podléhají rozkladu. Na oxidační stav +III narazíme v praxi častěji, opět se ale všechny koordinační sloučeniny rozkládají ve vodě. Konkrétního zástupce představuje K3[NiF6]. Paramagnetická krystalická látka fialové barvy, jejíž schopností je oxidace vody za vzniku kyslíku.
Nejvíce však dominuje oxidační stav +II. Koordinační sloučeniny dvojmocného niklu ve většině případů vzdorují oxidačním vlivům. Oblíbenými koordinačními čísly jsou hodnoty čtyři a šest, vyšší existuje pouze vzácně. Nejčastěji se vyskytují v oktaedrickém nebo tetraedrickém uspořádání, můžeme se setkat i s trigonální a tetragonální bipyramidou nebo se čtvercovou strukturou. Obvykle jsou komplexy paramagnetické, za nejoblíbenější ligandy se považují kyslík a dusík, upřednostňuje dusík v různých podobách. Amoniakáty mají v bezvodé formě následující podobu [Ni(NH3)6]2+, tento kation je fialový, po hydrataci se barva mění na různé odstíny modré.
Některé struktury se mohou měnit. Změna probíhá buď mezi oktaedrickou a čtvercovou strukturou anebo mezi tetraedrickou a čtvercovou strukturou. Příkladem je oktaedrická forma [Ni(ClO4)2(py)4] modré barvy, která existuje i ve žluté barvě čtvercové struktury jako [Ni(py)4]2+. [3][4][35][36][59][62]
Organokovové sloučeniny
[editovat | editovat zdroj]
Tetrakarbonyl niklu[4] (Ni(CO)4) je nažloutlá, těkavá a vysoce toxická kapalina. Oxidační stav niklu v této komplexní sloučenině odpovídá nule. Se sloučeninou jsme se již setkali při výrobě vysoce čistého niklu Mondovým procesem. Molekula krystalizuje v krychlové soustavě, nikl je obklopen čtyřmi karbonylovými ligandy, v nichž jsou atomy uhlíku a kyslíku propojeny trojnou vazbou. Vazba mezi uhlíkem a niklem je kovalentní. Pro člověka je tato sloučenina velmi nebezpečná, kůže ji rychle absorbuje, zároveň hrozí díky vysoké těkavosti vdechnutí. [3][4][36][62]
| Barva | Teplota tání (°C) | Hustota (g/cm3) | Rozpustný v? | |
|---|---|---|---|---|
| Tetrakarbonyl niklu | světle žlutá | -17,2 | 1,31 | kyselina dusičná |
Využití niklu
[editovat | editovat zdroj]Slitiny
[editovat | editovat zdroj]Primárně slouží nikl k výrobě slitin, nejvýznamnější z nich je nerezová ocel. Nerezová ocel je typická pro svou extrémní chemickou i elektrochemickou korozivzdornost. Známe čtyři typy, z nichž nikl obsahují dva, austenitická ocel a duplexní ocel. Austenitická ocel nebývá magnetická a dobře se tvaruje i svařuje. Používá se v nespočtu průmyslových odvětví. V lékařství narazíme například na nerezové chirurgické nástroje, také se z ní vyrábí pancéře či trezory. V běžné domácnosti se nachází nerezové dřezy, hrnce, příbory, případně i moderní architektura. Duplexní (austeniticko-feritická) ocel obsahuje kromě niklu i molybden, který zvyšuje houževnatost materiálu a odolnost proti korozi v napětí. Nevýhodou je, že při teplotách nad 700 °C křehne.
Monelův kov[60] je slitina mědi a niklu, v níž tvoří nikl 65 – 68 % objemu, měď okolo 30 %, zbylá procenta připadají příměsím. Obsahuje také menší podíl železa a manganu. Speciální odolnost Monelova kovu se projevuje v kontaktu se slanou vodou nebo v chemickém průmyslu. Používá se k výrobě trubek, kterými proudí voda, vyrábí se z něj lodní šrouby. Dá se použít u pájení jako distanční vrstva.
Slitiny niklu s mědí se mimo jiné uplatňují v mincovním průmyslu. V Československu se ze slitiny razily mince hodnoty 1, 2 a 5 Kčs, nyní slouží nikl pouze k poniklování ocelových mincí. Dále se slitiny niklu uplatňují ve šperkařství. Bíle zlato je slitinou zlata, niklu, mědi a zinku. Slitiny niklu bývají i součástí magnetů. Ze slitiny niklu a stříbra se vyrábí elektrické kontakty pro silnoproudé spínače, materiál je tvrdý a zároveň i elektricky vodivý. [3][12][57][59]
Antikorozní ochrana
[editovat | editovat zdroj]Nikl je stálý na vzduchu i ve vodě. Proto se používá k ochraně jiných kovů a slitin, například ocelí. Poniklování spočívá v elektrolytickém nanesení vrstvy na předmět v elektrolytu, který má záporný náboj a působí jako katoda. S poniklovanými předměty se setkáme ve stavebnictví (šroubováky, plechy, trubky), v lékařství či v domácnosti. Chemické nádobí se často nikluje, zvyšuje se tak odolnost nádobí vůči alkalickým taveninám. Pro reakce v kyselém prostředí není nikl dostačující, v těchto případech se používá spíše platina. [3][59]
Galvanické články
[editovat | editovat zdroj]Nikl se používá i v elektrotechnickém průmyslu. Galvanický článek představuje zdroj elektrického napětí, skládá se ze dvou elektrod ponořených v elektrolytu. V našem případě tvoří nikl ve formě oxidu kladnou elektrodu, zápornou elektrodou je kadmium nebo hydrid. Z niklu se vyrábí dobíjecí baterie. Mobilní telefony často používají nikl-hydridové baterie, zdroje o vyšší elektrické kapacitě mají v pozici katody kadmium. NiCd (nikl-kademnaté) baterie se používají v automobilových bateriích. [3][59]
Raneyův nikl
[editovat | editovat zdroj]Raneyův nikl byl objeven americkým inženýrem Murray Raneyem v roce 1926, použil jej k hydrogenaci rostlinných olejů. Zjistil, že rozštěpením dvojných vazeb uhlíkatého řetězce v esterech dává možnost existenci tuhých fází za laboratorní teploty. Jedná se o slitinu niklu s hliníkem, která se připravuje rozpuštěním niklu v tavenině hliníku, vzápětí se slitina prudce chladí (proces kalení). Pro aktivaci Raneyova niklu se slitina luhuje v koncentrovaném hydroxidu sodném, nikl je vůči působení hydroxidové skupiny inertní, hydroxid reaguje s hliníkem. Vodík se okamžitě sorbuje na povrch niklu, který se reakce s hydroxidem sodným neúčastní.
2 Al + 2 NaOH + 6 H2O → 2 Na[Al(OH)4] + 3 H2
Tento šedý prášek má díky obsahu vodíku silné hydrogenační účinky, z toho důvodu se používá jako katalyzátor v organických syntézách. Štěpí dvojnou vazbu mezi dvěma uhlíkovými atomy na jednoduchou, viz reakce níže. V praxi se reakce uplatňuje při hydrogenaci benzenového jádra, při přeměně glukózy na sorbitol nebo při převodu alkynů na parafíny. V potravinářství slouží ke ztužení tuků. [59][63]
R2C = CR2 + H2 → HR2C – CR2H
- Kde všude se můžeme v běžném životě setkat s niklem
-
Nerezová ocel v domácnosti
-
Vidlička z nerezové oceli
-
Zábradlí z nerezové oceli
-
Hodinkový náramek z nerezové oceli
-
Hydogenace benzenu
-
Konstrukce myčky nádobí je také vyrobená z nerezové oceli
-
Přívěsek na řetízek z nerezové oceli
Reaktivita niklu
[editovat | editovat zdroj]V porovnání se železem je nikl méně reaktivní. Elementární nikl je za laboratorních podmínek rezistentní vůči vodě i atmosféře, při zahřátí se pasivuje kompaktní vrstvou oxidu. V reakci s koncentrovanou kyselinou dusičnou se pasivuje, se zředěnými kyselinami reaguje pomalu, vzniká NiII sůl a vodík. Po zahřátí se slučuje s nekovy, konkrétně s borem, křemíkem, sírou, fosforem a s halogeny, za vzniku binárních sloučenin. S kyslíkem reaguje v žáru. Vůči alkalickým hydroxidům je vcelku odolný, z toho důvodu se používá pro konstrukce zařízení k výrobě chloridu sodného. [3][58][59]
Biochemie niklu
[editovat | editovat zdroj]Navzdory všem chemickým podobnostem s kobaltem, není nikl na rozdíl od ostatních prvků triády železa esenciální součástí lidského života. Nebyly prokázány, žádné pozitivní účinky na organismus, stejně tak nebyl pozorován negativní vliv nedostatku niklu v těle člověka. Neznamená to, že nemá nikl v přírodě z biologického hlediska žádný účel. Je důležitý pro některé rostliny, řasy a houby. Jedním z hlavních enzymů niklu je ureáza, která má na starost hydrolýzu močoviny za vzniku amoniaku a karbamátu. Jedná se o metaloenzym s vysokou molekulární hmotností. Díky zásaditosti amoniaku se během aktivního zapojení ureázy zvyšuje pH. Dále je nikl součástí mnoha jiných enzymů a kofaktorů rostlin, řas a hub. [3][58][59]
Toxicita niklu
[editovat | editovat zdroj]Negativní účinky závisí na množství a době vystavení niklu. Nikl a jeho sloučeniny, převážně oxidy a sulfidy, se řadí mezi kožní alergeny. Spousta z nich patří do první kategorie karcinogenů. Za nejvíce jedovatou sloučeninu niklu se považuje tetrakarbonyl niklu. Citlivost na nikl si může člověk vytvořit sám, pokud nosí šperky vyrobené z niklu dlouhodobě, pokožka může časem začít reagovat. Následně se pak při jakémkoliv kontaktu s niklem tvoří vyrážka v oblasti doteku, výjimečně může být alergie natolik vysoká, že vyvolá astmatický záchvat. Není to však pravidlem, nošení niklových šperků nevyvolává alergické reakce u všech jedinců.
Pozření či vdechnutí velkého množství může způsobovat svědění a vyrážky na rukou, zvracení, případně bolesti žaludku a ledvin. Dlouhodobé vdechování způsobuje bronchitidu, zhoršuje dýchání, hrozí rakovina plic. V současnosti se nikl řadí mezi teratogeny, což znamená, že častá expozice anebo přítomnost niklu v organismu, může mít negativní následky na vývoj plodu. [3][58][59]
Odkazy
[editovat | editovat zdroj]Reference
[editovat | editovat zdroj]- ↑ 1,0 1,1 1,2 1,3 1,4 1,5 ROUBAL, Jiří. Základy obecné a anorganické chemie druhý díl [online]. Pro vyšší stupeň gymnázia v Duchcově [cit. 2023-01-26]. Dostupné z: http://www.chesapeake.cz/chemie/download/skripta/anorganicka_chemie.pdf
- ↑ 2,0 2,1 2,2 Anorganická chemie, HOUSECROFT (viz literatura), strana 703.
- ↑ 3,00 3,01 3,02 3,03 3,04 3,05 3,06 3,07 3,08 3,09 3,10 3,11 3,12 3,13 3,14 3,15 3,16 3,17 3,18 3,19 3,20 3,21 3,22 3,23 3,24 3,25 3,26 3,27 3,28 3,29 3,30 NICHOLLS, D. The chemistry of iron, cobalt and nickel [online]. Oxford: Pergamon Press, 1975 [cit. 2023-02-04]. Pergamon texts in inorganic chemistry. ISBN 00-801-8874-5. Dostupné z: https://books.google.cz/books?hl=en&lr=&id=pD79BAAAQBAJ&oi=fnd&pg=PP1&dq=inorganic+chemistry+iron&ots=kzrdGblZvo&sig=Fx-UVdr5Ybzhscy9Or_3g2ouGP8&redir_esc=y#v=onepage&q=inorganic%20chemistry%20iron&f=false
- ↑ 4,00 4,01 4,02 4,03 4,04 4,05 4,06 4,07 4,08 4,09 4,10 4,11 4,12 4,13 4,14 4,15 4,16 4,17 4,18 4,19 4,20 4,21 4,22 4,23 Autor neznámý. Železo, kobalt, nikl [online]. Brno, 2005 [cit. 2023-01-28]. Dostupné z: https://is.muni.cz/el/1431/jaro2005/C2442/skripta/kapitola2202.html
- ↑ 5,0 5,1 5,2 5,3 5,4 5,5 5,6 Chemie prvků (viz literatura), železo, strana 1320 - 1374.
- ↑ 6,0 6,1 6,2 6,3 6,4 6,5 Anorganická chemie, HOUSECROFT (viz literatura), strana 738 - 744
- ↑ 7,0 7,1 7,2 7,3 7,4 7,5 Obecná a anorganická chemie I (viz literatura)
- ↑ 8,0 8,1 8,2 8,3 Anorganická chemie 4.vyd, KAMENÍČEK (viz literatura)
- ↑ Doc. Dr. Ing. VOJTĚCH, Dalibor. Kovové materiály [online]. Praha: VŠCHT Praha, 2006, str. 87 – 93 [cit. 2023-02-04]. ISBN 80-7080-600-1. Dostupné z: http://147.33.74.135/knihy/uid_isbn-80-7080-600-1/pages-pdf/087.html
- ↑ 10,0 10,1 10,2 Ing. MELUZIN, Ladislav. Stroje a zařízení: Železo, ocel [online]. Ostrava [cit. 2023-02-06]. Dostupné z: https://www.fbi.vsb.cz/export/sites/fbi/050/.content/galerie-souboru/studijni-materialy/zelezo.pdf
- ↑ 11,0 11,1 11,2 11,3 11,4 11,5 11,6 11,7 11,8 Chemie prvků (viz literatura), kobalt, strana 1375 - 1416.
- ↑ 12,0 12,1 12,2 12,3 12,4 12,5 12,6 12,7 Doc. Ing. CHOTĚBORSKÝ, Rostislav, Ph.D. Nauka o materiálu [online]. V Praze: Česká zemědělská univerzita, 2011, str. 111 – 275 [cit. 2023-02-16]. ISBN 978-80-213-2236-3. Dostupné z: https://optdiary.files.wordpress.com/2018/03/nauka-o-materic3a1lu-2011-skripta.pdf
- ↑ 13,0 13,1 SMETANOVÁ, Anna. Strukturní složky oceli [online]. Kuřim, 2012 [cit. 2023-03-01]. Dostupné z: https://www.zamekkurim.cz/security/Dum%20-%20Digitalni%20ucebni%20materialy/13_Sada_Materialy_2/VY_32_INOVACE_13_12_Strukturni_slozky_oceli.pdf
- ↑ 14,0 14,1 BARTHELMY, David. Mineral Species containing Iron. In: Mineralogy Database [online]. 2010 [cit. 2023-03-10]. Dostupné z: http://webmineral.com/chem/Chem-Fe.shtml#.ZFzXgXZBy3D
- ↑ Autor neznámý. Carbonyl Iron powder: An insight on global market [online]. 2020 [cit. 2023-03-20]. Dostupné z: https://imp-india.com/carbonyl-iron-powder-an-insight-on-global-market/
- ↑ Autor neznámý. The CIP technology: How is carbonyl iron manufactured [online]. [cit. 2023-03-20]. Dostupné z: https://electronics-electric.basf.com/global/en/electronics/products/carbonyl_iron_powder/the-cip-technology.html
- ↑ 17,0 17,1 Anorganická chemie, HOUSECROFT (viz literatura), strana 175
- ↑ 18,0 18,1 Mgr. JANOVEC, Jan, Ph.D. Technické materiály v primárním a preprimárním vzdělávání. V Ústí nad Labem: Univerzita J.E. Purkyně, 2013. ISBN 978-80-7414-596-4. Dostupné také z: http://old.projekty.ujep.cz/combiteachers/wp-content/uploads/2013/04/tech_mat_v_primarnim_a_preprimarnim_vzdelavani_autor_Jan_Jalove.pdf
- ↑ 19,0 19,1 19,2 Autor neznámý. Kovy [online]. str. 1 – 11 [cit. 2023-02-15]. Dostupné z: http://homel.vsb.cz/~khe0007/Predmety/Stavebni%20hmoty/Prednaska_kovy.pdf
- ↑ JANČAR, Rostislav. Jak se vyrábí koks pro největší huť. In: Idnes.cz [online]. 2015 [cit. 2023-02-21]. Dostupné z: https://www.idnes.cz/technet/reportaze/koks-pro-ostravskou-hut.A150528_144406_tec_reportaze_rja
- ↑ Autor neznámý. Úvodem o koksu[online]. In: OKK [cit. 2023-03-11]. Dostupné z: https://www.koksovny.cz/cz/uvodem-o-koksu
- ↑ Autor neznámý. Výroba železa a oceli [online]. Brno [cit. 2023-02-16]. Dostupné z: https://www.ped.muni.cz/wchem/sm/hc/zfc/vyroby/vyroba-zeleza.pdf
- ↑ 23,0 23,1 Autor neznámý. Technické materiály: Výroba železa, oceli, litiny [online]. ESF, MŠMT [cit. 2023-02-16]. Dostupné z: https://www.spszengrova.cz/wp-content/uploads/2020/04/ZAV1-Technicke_materialy_Vyroba_zeleza.pdf
- ↑ 24,0 24,1 VIDEO. LIBERTY OSTRAVA. Jak se vyrábí železo a ocel [online]. 2013 [cit. 2023-02-16]. Dostupné z: https://www.youtube.com/watch?v=b3BOMfH7Dbc
- ↑ 25,0 25,1 25,2 25,3 Autor neznámý. Výroba oceli a litiny [online]. ESF, MŠMT [cit. 2023-02-18]. Dostupné z: https://digit.isste.cz/op-hs/assets/-158899443586.%20Vyroba%20oceli%20a%20litiny.pdf
- ↑ 26,0 26,1 26,2 ŠŤASTNÁ, Hana. Chemie železa, výroba oceli a litiny [online]. Bakalářská práce. Brno, 2009 [cit. 2023-02-04]. Dostupné z: https://is.muni.cz/th/u4dd9/BP.pdf
- ↑ ROJEK, Lukáš. Legováním za lepšími vlastnostmi ocelí [online]. 2019 [cit. 2023-03-01]. Dostupné z: https://www.top-armyshop.cz/magazin/legovanim-za-lepsimi-vlastnostmi-oceli
- ↑ Autor neznámý. Tepelné zpracování: Popouštění [online]. [cit. 2023-02-15]. Dostupné z: https://www.bodycote.com/cs/sluzby/tepelne-zpracovani/kaleni-popusteni-zuslechteni/popousteni/
- ↑ WILSON, Robert E. The Mechanism of the Corrosion of Iron [online]. 1923, 15(4), 426-427 [cit. 2023-05-12]. ISSN 0019-7866. Dostupné z: doi:10.1021/ie50160a872
- ↑ 30,0 30,1 WHITMAN, Walter G. Corrosion of Iron. In: Chemical Reviews [online]. 1926, 2(4), 419-435 [cit. 2023-05-12]. ISSN 0009-2665. Dostupné z: doi:10.1021/cr60008a003
- ↑ 31,0 31,1 Autor neznámý. Koroze [online]. ESF, MŠMT [cit. 2023-05-12]. Dostupné z: https://www.spszengrova.cz/wp-content/uploads/2020/04/ZAV1-Povrchove_upravy.pdf
- ↑ 32,0 32,1 HAVLÍK, Luboš. Koroze slitin železa a způsoby jejich vyhodnocování [online]. BP. Brno: VUT Fakulta Strojního Inženýrství, 2010 [cit. 2023-05-12]. Dostupné z: https://www.vut.cz/www_base/zav_prace_soubor_verejne.php?file_id=25912
- ↑ Autor neznámý. Corrosion [online]. In: LibreTexts [cit. 2023-05-12]. Dostupné z: https://chem.libretexts.org/Bookshelves/Introductory_Chemistry/Introductory_Chemistry_(CK-12)/22%3A_Oxidation-Reduction_Reactions/22.05%3A_Corrosion
- ↑ Autor neznámý. Koroze. One Industry [online]. 2019 [cit. 2023-04-13]. Dostupné z: https://www.oneindustry.cz/lexikon/koroze/
- ↑ 35,00 35,01 35,02 35,03 35,04 35,05 35,06 35,07 35,08 35,09 35,10 35,11 35,12 35,13 35,14 35,15 35,16 Autor neznámý. Chemie: Železo, kobalt, nikl [online]. Liberec, 2003 - 2006 [cit. 2023-02-23]. Dostupné z: http://chemie.gfxs.cz/index.php?pg=tabulka
- ↑ 36,00 36,01 36,02 36,03 36,04 36,05 36,06 36,07 36,08 36,09 36,10 36,11 36,12 36,13 36,14 36,15 36,16 36,17 Autor neznámý. Sloučeniny železa, kobaltu, niklu. In: Chemical book [online]. [cit. 2023-04-14]. Dostupné z: https://www.chemicalbook.com/ProductIndex_EN.aspx
- ↑ 37,0 37,1 37,2 37,3 37,4 Anorganická chemie, HOUSECROFT (viz literatura), strana 730 - 738
- ↑ 38,0 38,1 38,2 38,3 38,4 38,5 38,6 38,7 KRPOUN, Karel. Železo a jeho sloučeniny [online]. Brno, 2008 [cit. 2023-03-11]. Dostupné z: https://www.vut.cz/www_base/zav_prace_soubor_verejne.php?file_id=8465
- ↑ BHUIYAN, Tanzila. Uses of steel. In: Civil engineering [online]. [cit. 2023-05-23]. Dostupné z: https://civiltoday.com/civil-engineering-materials/steel/214-uses-of-steels
- ↑ OBRŠLIKOVÁ, B. Železobeton. In: Stavimbydlim [online]. 2021 [cit. 2023-05-24]. Dostupné z: https://stavimbydlim.cz/zelezobeton-jak-se-vyrabi-a-jake-ma-vlastnosti/
- ↑ Autor neznámý. Železobeton. In: EBeton [online]. [cit. 2023-05-24]. Dostupné z: https://www.ebeton.cz/pojmy/zelezobeton-zelezovy-beton/
- ↑ Ing. MĚŘÍNSKÝ, Tomáš. Ocel ve stavebnictví. In: ASB [online]. 2008 [cit. 2023-05-24]. Dostupné z: https://www.asb-portal.cz/stavebnictvi/ocel-ve-stavebnictvi
- ↑ Autor neznámý. Ocel ve stavebnictví. In: Ceskestavby [online]. 2009 [cit. 2023-05-24]. Dostupné z: https://www.ceskestavby.cz/clanky/ocel-5955.html
- ↑ Autor neznámý. Ocel ve stavebnictví. In: AllPlan [online]. 2022-06 [cit. 2023-05-24]. Dostupné z: https://blog.allplan.com/cz/ocel-ve-stavebnictv%C3%AD
- ↑ CLARK, Jim. Chemistry of iron [online]. Truro school in Cornwall: LibreTexts chemistry [cit. 2023-02-11]. Dostupné z: https://chem.libretexts.org/Bookshelves/Inorganic_Chemistry/Supplemental_Modules_and_Websites_(Inorganic_Chemistry)/Descriptive_Chemistry/Elements_Organized_by_Block/3_d-Block_Elements/Group_08%3A_Transition_Metals/Chemistry_of_Iron
- ↑ 46,0 46,1 46,2 SEDLÁČKOVÁ, Terezie, J. RACEK. Metabolismus železa a jeho regulace [online]. Plzeň: Ústav klinické biologie a hematologie LF UK a FN v Plzni, 2009 [cit. 2023-03-11]. Dostupné z: http://www.cskb.cz/res/file/KBM-pdf/2009/1-09/2009-1-Sedlackova.pdf
- ↑ 47,0 47,1 47,2 Doc. MUDr. VYORAL, Daniel, CSc., J. PETRÁK. Metabolismus železa a jeho regulace [online]. Praha, 2015 [cit. 2023-03-21]. Dostupné z: https://www.casopisvnitrnilekarstvi.cz/pdfs/vnl/2012/89/15.pdf
- ↑ 48,0 48,1 48,2 48,3 Anorganická chemie, HOUSECROFT (viz literatura), strana 1042 - 1053.
- ↑ 49,00 49,01 49,02 49,03 49,04 49,05 49,06 49,07 49,08 49,09 49,10 49,11 49,12 CLARK, Jim. Chemistry of cobalt [online]. Truro school in Cornwall: LibreTexts chemistry [cit. 2023-04-12]. Dostupné z: https://chem.libretexts.org/Bookshelves/Inorganic_Chemistry/Supplemental_Modules_and_Websites_(Inorganic_Chemistry)/Descriptive_Chemistry/Elements_Organized_by_Block/3_d-Block_Elements/Group_09%3A_Transition_Metals/Chemistry_of_Cobalt
- ↑ BARTHELMY, David. Mineral Species containing Iron. In: Mineralogy Database [online]. 2010 [cit. 2023-03-10]. Dostupné z: http://webmineral.com/chem/Chem-names-Co.shtml
- ↑ Autor neznámý. Cobalt extraction. In: Wikipedia: the free encyclopedia [online]. San Francisco (CA): Wikimedia Foundation, 2023 [cit. 2023-05-13]. Dostupné z: https://en.wikipedia.org/wiki/Cobalt_extraction
- ↑ 52,0 52,1 MSETEKA, Lloyd Masuzyo. Recovery of cobalt and copper [online]. KTH Vetenskap och konst, 2021, str. 9 – 14 [cit. 2023-05-16]. Dostupné z: http://kth.diva-portal.org/smash/get/diva2:1627048/FULLTEXT01.pdf
- ↑ 53,0 53,1 Autor neznámý. How sherritt refines metals [online]. Canada: Sherritt international corporation, 2017 [cit. 2023-05-13]. Dostupné z: https://s2.q4cdn.com/343762060/files/doc_downloads/How_Sherritt_Refines_Metals_2017.pdf
- ↑ Autor neznámý. Cobalt(II) hydroxide. Chemical book [online]. [cit. 2023-04-14]. Dostupné z: https://www.chemicalbook.com/ChemicalProductProperty_EN_CB0716301.htm
- ↑ Autor neznámý. Čtyři věci, které jste nevěděli o pneumatikách [online]. AZ PNEU: Pneumatiky od A do Z, 2003 – 2023 [cit. 2023-05-16]. Dostupné z: https://www.az-pneu.cz/clanky/4-veci-ktere-jste-nevedeli-o-pneumatikach
- ↑ Autor neznámý. Obsah kobaltu v katodovém materiálu [online]. [cit. 2023-05-13]. Dostupné z: https://www.mt.com/cz/cs/home/supportive_content/ana_chem_applications/titration/M829.html
- ↑ 57,0 57,1 Autor neznámý. Nickel, Cobalt and their Alloys [online]. USA: ASM international, 2000 [cit. 2023-05-13]. ISBN 0-87170-685-7. Dostupné z: https://books.google.cz/books?id=IePhmnbmRWkC&q=cobalt+copper+nickel+ore+separate&redir_esc=y#v=onepage&q&f=false
- ↑ 58,0 58,1 58,2 58,3 58,4 58,5 58,6 Chemie prvků (viz literatura), nikl, strana 1416 - 1454.
- ↑ 59,00 59,01 59,02 59,03 59,04 59,05 59,06 59,07 59,08 59,09 59,10 59,11 59,12 59,13 59,14 Prof. LANCASHIRE, Robert J. Chemistry of nickel [online]. University of the West Indies in Mona: LibreTexts chemistry [cit. 2023-04-22]. Dostupné z: https://chem.libretexts.org/Bookshelves/Inorganic_Chemistry/Supplemental_Modules_and_Websites_(Inorganic_Chemistry)/Descriptive_Chemistry/Elements_Organized_by_Block/3_d-Block_Elements/Group_10%3A_Transition_Metals/Chemistry_of_Nickel
- ↑ 60,0 60,1 60,2 Autor neznámý. Chemické prvky [online]. Praha: Přírodovědecká fakulta UK, 2015 [cit. 2023-05-13]. Dostupné z: https://www.chemickeprvky.cz/
- ↑ BARTHELMY, David. Mineral Species containing Iron. In: Mineralogy Database [online]. 2010 [cit. 2023-03-10]. Dostupné z: http://webmineral.com/chem/Chem-Ni.shtml
- ↑ 62,0 62,1 62,2 62,3 62,4 62,5 62,6 Anorganická chemie, HOUSECROFT (viz literatura), strana 744 - 748
- ↑ TARBELL, D. Stanley, Ann Tracy TARBELL. Murray Raney of Chattanooga and nickel catalysts. In: Journal of Chemical Education [online]. 1977, 54(1) [cit. 2023-05-16]. ISSN 0021-9584. Dostupné z: doi:10.1021/ed054p26
Literatura
[editovat | editovat zdroj]- EARNSHAW, Alan; GREENWOOD, Norman Neill. Chemie prvků. Praha : Informatorium, 1993. ISBN 80-85427-38-9.
- HOUSECROFT, Catherine E.; SHARPE, Alan G.. Anorganická chemie. Praha : VŠCHT, 2014. ISBN 978-80-7080-872-6.
- KLIKORKA, Jiří. Obecná a anorganická chemie I. Praha : Státní nakladatelství technické literatury, 1981.
- LUKEŠ, Ivan. Anorganická chemie díl 2. Praha : Karolinum, 1998. ISBN 80-7184-663-5.
- COTTON, F. Albert; WILKINSON, Geoffrey. Anorganická chemie souborné zpracování pro pokročilé. Praha : Academia, 1973. ISBN (váz.).
- KAMENÍČEK, Jiří. Anorganická chemie, 4.vyd.. Olomouc : Univerzita Palackého v Olomouci, 2009. ISBN 978-80-244-2387-6.