Anorganická chemie/Krystalové struktury
Krystal je pevná látka, v níž jsou stavební prvky (atomy, molekuly nebo ionty) pravidelně uspořádány v opakujícím se vzoru (tzv. elementární buňce), který se zachovává na velké vzdálenosti (oproti atomárním měřítkům).
Podle typu vazby mezi atomy v krystalu rozlišujeme:
- iontové krystaly - atomy jsou vázány iontovou vazbou, jde např. o halogenidy alkalických kovů (NaCl, CsF)
- kovalentní krystaly - atomy jsou vázány kovalentní vazbou, jde často o krystaly prvků nebo organických sloučenin (SiO2, diamant)
- kovové krystaly - jsou tvořeny kovy, jejich struktura sestává z kladných iontů obklopených tzv. elektronovým plynem (Cu, Fe)
- molekulární krystaly - molekuly jsou v krystalu propojeny nekovalentními interakcemi (HCl, organické sloučeniny)[1]
V roce 1992 byla definice krystalu změněna, došlo k tomu na základě objevu kvazikrystalů:
Polohy atomů v elementární krystalové buňce
[editovat | editovat zdroj]V elementární buňce rozlišujeme čtyři typy poloh:
- Poloha uvnitř buňky, atom patří celý do jediné buňky
- Poloha ve středu stěny, atom je sdílen dvěma buňkami. V konkrétní buňce je umístěna polovina atomu.
- Poloha ve středu hrany, atom je sdílen čtyřmi buňkami. V konkrétní buňce je umístěna čtvrtina atomu.
- Poloha ve vrcholu buňky, atom je sdílen osmi buňkami. V konkrétní buňce je umístěna osmina atomu.

U chloridu cesného (CsCl) je ion Cs+ umístěn uvnitř krystalové buňky, takže patří celý dané buňce. V rozích krychle je umístěno osm chloridových iontů, osmina každého chloridu tedy patří dané buňce, tím získáme jeden chloridový ion.
Strukturní typy
[editovat | editovat zdroj]Tato kapitola je věnována běžným strukturním typům, ve kterých krystalují sloučeniny se vzorci MX, MX2, M2X a MM'X3. Strukturní typy se označují jménem, nebo vzorcem vybrané sloučeniny, která v této struktuře krystaluje.
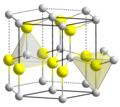
Halit
[editovat | editovat zdroj]Halit, neboli sůl kamenná, krystaluje v plošně centrované kubické mřížce, v každé buňce jsou čtyři sodné a čtyři chloridové ionty. Ionty se nacházejí ve vrcholech krychle a ve středech jejích stěn. Každý ion je ve struktuře obklopen šesti opačně nabitými ionty v oktaedrické konfiguraci.

V tomto strukturním typu krystalují např. NaF, NaBr, CsF, MgO, CaO, MgS a CaS.
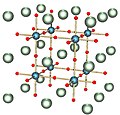
Chlorid cesný
[editovat | editovat zdroj]Chlorid cesný krystaluje v tělesně centrované kubické mřížce, tato struktura je charakteristická pro halogenidy s ionty o podobném poloměru (Cs+ 174 pm; Cl- 181 pm). Každý ion je koordinován osmi opačnými ionty, jde vlastně o dvě spojené kubické soustavy. V této soustavě krystaluje také CsBr, CsI, TlCl, TlBr, NH4Cl a NH4Br.

Arsenid nikelnatý
[editovat | editovat zdroj]Struktura NiAs je podobná struktuře halitu, ale anionty As2- jsou uspořádány do nejtěsnějšího hexagonálního uspořádání a kationty Ni2+ obsazují oktaedrické mezery.[4]
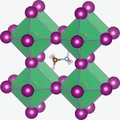
Fluorit
[editovat | editovat zdroj]Fluorit, neboli fluorid vápenatý, krystaluje v kubické, plošně centrované struktuře. Každý kation má koordinační číslo osm a anionty mají koordinační číslo 4. Kromě CaF2 krystaluje v této struktuře i CeO2, ThO2 nebo NpO2.

Antifluorit
[editovat | editovat zdroj]Pokud ve struktuře fluoritu vyměníme kationty za anionty, získáme antifluoritovou strukturu, ve které krystalují oxidy a sulfidy kovů 1. skupiny, M2O a M2S. Jedinou výjimkou je Cs2O, který má strukturu CdI2.

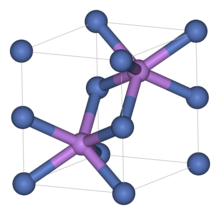
Sfalerit
[editovat | editovat zdroj]Strukturu sfaleritu, ZnS, lze odvodit z fluoritu odstraněním poloviny aniontů. Druhou možností je vyjít ze struktury diamantu, která je tvořena teraedricky koordinovanými atomy uhlíku. Ve sfaleritu mají všechny atomy také tetraedrickou koordinaci, ale pravidelně se střídá zinek a síra. V této struktuře krystalují také polovodiče, jako GaAs nebo CdTe.

Kristobalit
[editovat | editovat zdroj]Krisotbalit je modifikace SiO2, skládá se z tetraedrů SiO4 propojených vrcholy. Úhel Si-O-Si je 144°.

Wurtzit
[editovat | editovat zdroj]Wurtzit je další krystalovou modifikací ZnS, na rozdíl od sfaleritu, je uspořádání hexagonální. Ionty zinku i síry jsou koordinovány tetraedricky.
Perovskit
[editovat | editovat zdroj]Perovskit je příkladem podvojného oxidu, jde o oxid vápenato-titaničitý, CaTiO3. Krystaluje v kubické soustavě, titaničité ionty jsou v rozích krychle, vápenaté v těžišti krychle a kyslíky ve středech stran. Vápenaté ionty jsou koordinovány dvanácti kyslíky, titaničité šesti.
-
Struktura perovskitu, červené atomy jsou kyslíky, modré titan a zelené vápník
Odkazy
[editovat | editovat zdroj]Reference
[editovat | editovat zdroj]- ↑ Organic Molecular Crystals
- ↑ Crystal
- ↑ Report of the Executive Committee for 1991
- ↑ Základní typy krystalových struktur [online]. [Cit. 2023-07-05]. Dostupné online.
Literatura
[editovat | editovat zdroj]- HOUSECROFT, Catherine E.; SHARPE, Alan G.. Anorganická chemie. 1.. vyd. [s.l.] : [s.n.], 2014. 1152 s. ISBN 978-80-7080-872-6. S. 181-186.
- Crystal Structure